
A��B��C��D��E���ֶ�����Ԫ�أ����ǵ�ԭ��������������AԪ�ص�������������������ͬ��AԪ��ԭ�Ӱ뾶��С��BԪ�ص�����������Ӧˮ���������⻯����������M��D��Aͬ���壬����Eͬ���ڣ�EԪ��ԭ�ӵ������������ȴ�����������2��A��B��D��E������Ԫ�أ�ÿһ����CԪ�ض����γ�ԭ�Ӹ����Ȳ���ͬ�������ֻ����
��ش��������⣺
��1�� C��E����Ԫ����Ƚϣ��ǽ�����ǿ��Ԫ�������ڱ��е�λ��Ϊ ��������
��˵���У�������֤C��E�ǽ�����ǿ�����ǣ���д��ţ� ��
a���Ƚ�������Ԫ�صij������ʵķе�
b�������γɵĻ������У�CԪ�ص�ԭ���Ը���
c���Ƚ�������Ԫ�ص���̬�⻯����ȶ���
��2�� B��DԪ�����γɻ�����ĵ���ʽΪ____________________��B��C��D Ԫ��ԭ������Ӧ���Ӱ뾶�ɴ�С��˳��Ϊ________________________________;
��3����M�к��еĻ�ѧ�������� �� ��
��4��д����A��C��D��E����Ԫ�ع�ͬ�γɵ����ֻ�������ˮ��Һ�����Ӧ�����ӷ���ʽΪ ��
��5��B2A4��һ�ֿ�ȼ��Һ�壬B2A4������ȼ�ϵ����һ�ּ���ȼ�ϵ�أ�B2A4����������ΪB2�����ϵĵ缫��ӦʽΪ ��
��6����֪1mol D��ˮ��Ӧ�ų�283.5kJ����������д��D��ˮ��Ӧ���Ȼ�ѧ��Ӧ����ʽ ��
(14��)��1���ڶ����ڢ�A�� ( 1��) ��bc (2��)
��2�� 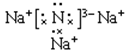 (1��)��r(N 3-) > r(O2-) > r(Na+) (2��)
(1��)��r(N 3-) > r(O2-) > r(Na+) (2��)
��3�����Ӽ������ۼ� (2��) ��4��HSO3����H�� = H2O��SO2�� (2��)
��5��N2H4+ 4OH����4e��= 4H2O��N2 (2��)
��6��2Na(s)+2H2O(l)=2NaOH(aq)+H2(g) ��H =" �C567" kJ/mol (2��)
�������������AԪ�ص�������������������ͬ��AԪ��ԭ�Ӱ뾶��ԭ��������С������A����Ԫ�ء�BԪ�ص�����������Ӧˮ���������⻯����������M����B�ǵ�Ԫ�أ�M������泥�D��Aͬ���壬����Eͬ���ڣ���D��ԭ���������ڵ�Ԫ�صģ���С��EԪ�صģ�����DӦ������Ԫ�أ�EԪ��ԭ�ӵ������������ȴ�����������2����E��SԪ�أ�A��B��D��E������Ԫ�أ�ÿһ����CԪ�ض����γ�ԭ�Ӹ����Ȳ���ͬ�������ֻ������˸���C��ԭ������С���ƵĴ���N�Ŀ�֪��Cһ������Ԫ�ء�
��1��ͬ�������϶��·ǽ��������ͣ����Էǽ�����ǿ������Ԫ�أ�λ�ڵڶ����ڵڢ�A�塣�ǽ�����ǿ���뵥�ʵķе���ϵ��a����ȷ�������γɵĻ������У�CԪ�ص�ԭ���Ը��ۣ�˵��C�ڷ�Ӧ�еõ����ӣ����ڷǽ�����ǿ��b��ȷ���ǽ�����Խǿ�⻯����ȶ���Խǿ������c��ȷ����ѡbc��
��2��B��DԪ�����γɻ������ǵ����ƣ��������Ӽ������ӻ�����������ʽΪ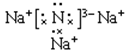 ����������Ų���ͬ�����������Ӱ뾶��ԭ���������������С�����B��C��D Ԫ��ԭ������Ӧ���Ӱ뾶�ɴ�С��˳��Ϊr(N 3-) > r(O2-) > r(Na+)��
����������Ų���ͬ�����������Ӱ뾶��ԭ���������������С�����B��C��D Ԫ��ԭ������Ӧ���Ӱ뾶�ɴ�С��˳��Ϊr(N 3-) > r(O2-) > r(Na+)��
��3��������к��еĻ�ѧ�������Ӽ��ͼ��Լ���
��4��A��C��D��E����Ԫ�ع�ͬ�γɵ����ֻ�������ˮ��Һ�����Ӧ����˵�����ֻ�����Ӧ�����������ƺ����������ƣ���Ӧ�����ӷ���ʽ��HSO3����H�� = H2O��SO2����
��5����ԭ����и���ʧȥ���ӣ������N2H4�����������ǵ�����֪�������ϵĵ缫��ӦʽΪN2H4+ 4OH����4e��= 4H2O��N2��
��6��1mol����ˮ��Ӧ�ų�283.5kJ��������������ˮ��Ӧ���Ȼ�ѧ��Ӧ������2Na(s)+2H2O(l)=2NaOH(aq)+H2(g) ��H =" �C567" kJ/mol��
���㣺����Ԫ�����ڱ��Ľṹ��Ԫ�������ɵ�Ӧ�á�����ʽ����ѧ�����缫��Ӧʽ���Ȼ�ѧ����ʽ����д
�����������Ǹ߿��еij������ͣ������е��Ѷȵ����⡣�����ۺ���ǿ�����ض�ѧ������֪ʶ�Ĺ��̺�ѵ�������������ѧ����������������Ӧ��������������Ҫ��Ԫ�ء�λ�������ԡ����߹�ϵ���ۺϿ��飬�Ƚ�ȫ�濼��ѧ���й�Ԫ���ƶ�֪ʶ���������֪ʶ�������������ԡ����ڱ���Ԫ�ص��ƶϡ�Ϊ���壬����ѧ����Ԫ�����ڱ�����Ϥ�̶ȼ���Ա��и�Ԫ�����ʺ���Ӧԭ�ӽṹ�������Եݱ���ɵ���ʶ�����ճ̶ȡ�������ѧ�������ʽṹ�����ʹ�ϵ�Լ�����Ԫ�������ɽ�����廯ѧ�����������


 �㽭��У��ʦ���ϵ�д�
�㽭��У��ʦ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����¶� Ũ�� |
a���� 400�� |
b���� 425�� |
c���� 450�� |
d���� 475�� |
e���� 500�� |
| c��O2�� | 0.8 | 0.6 | 0.3 | 0.5 | 0.7 |
| c��SO3�� | 0.4 | 0.8 | 1.4 | 1.0 | 0.6 |

| c2(SO3) |
| c2(SO2)��c(O2) |
| c2(SO3) |
| c2(SO2)��c(O2) |


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�



| ��O3 | ��Zn��H2O |




�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 Ԫ�����ڱ������ڵ�һ���������ʾ�������й�A��B��C��D��E����Ԫ�ص������У���ȷ���ǣ�������
Ԫ�����ڱ������ڵ�һ���������ʾ�������й�A��B��C��D��E����Ԫ�ص������У���ȷ���ǣ��������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com