
 2SO3(g)△H<0
2SO3(g)△H<0

| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |


科目:高中化学 来源: 题型:
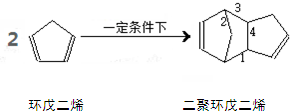
| A、1 | B、2 | C、3 | D、4 |
查看答案和解析>>
科目:高中化学 来源: 题型:013
据最近的美国《农业研究》杂志报道,美国科学家已发现半胱氨酸能增强艾滋病毒感染的免疫力,对控制艾滋病毒的蔓延有奇效。已知半胱氨酸的结构简式为:
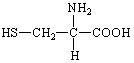 则下列说法错误的是( )
则下列说法错误的是( )
A.半胱氨酸能与Mg作用放出H2
B.半胱氨酸能与NaOH作用又能与盐酸作用
C.![]() 不与NaOH作用,而能与盐酸作用
不与NaOH作用,而能与盐酸作用
D.两分子半胱氨酸在一定条件下形成二肽的结构简式为:
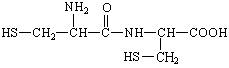
查看答案和解析>>
科目:高中化学 来源: 题型:
 。下列关于半胱氨酸的说法中不正确的是( )
。下列关于半胱氨酸的说法中不正确的是( )A.半胱氨酸能与Mg作用放出H2
B.半胱氨酸可以形成![]() 盐
盐
C.1 mol半胱氨酸可以与2 mol NaOH作用
D.半胱氨酸可以在一定条件下形成二肽的结构是:
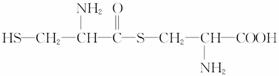
查看答案和解析>>
科目:高中化学 来源: 题型:
(08上海嘉定区期末)乙炔和甲烷都是重要的化工原料。A具有香味。.

(1)写出实验室制取乙炔的化学方程式:
。
(2)甲烷与氯气混合,光照发生反应时产物的化学式有:_____________________________(3)X和A具有相同的官能团为 (填名称),实验室证明该官能团所用的试剂和条件为 ______________。
(4)乙炔在一定条件下发生二分子聚合、三分子聚合、四分子聚合后分别生成![]() (乙烯基乙炔)、
(乙烯基乙炔)、![]() (二乙烯基乙炔)、
(二乙烯基乙炔)、 ![]() 、
、![]() (环辛四烯),在这四种物质中分别加入溴水,不能发生加成反应的是
(环辛四烯),在这四种物质中分别加入溴水,不能发生加成反应的是
。
(6)写出Y、Z反应生成A的化学方程式________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com