
(14分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注
⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1molCO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①反应开始到平衡,H2的平均反应速率v(H2)=_____mol/(L·min)。H2的转化率为 。
②下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A、升高温度 B、充入He(g),使体系压强增大
C、将H2O(g)从体系中分离 D、再充入1mol CO2和3mol H2
E、使用催化剂 F、缩小容器体积
⑵①反应进行到3分钟时,同种物质的v正 与v逆的关系: v正 v逆 (填>,=,<)
②上述反应平衡常数的表达式为 ,经计算该温度下此反应平衡常数的数值为 。
科目:高中化学 来源:2012-2013学年湖北省襄阳市高三调研三月统一测试理综化学试卷(解析版) 题型:填空题
(14分) 电池的发明和应用是化学家们对人类社会的重要贡献之一。
Ⅰ.每一次化学电池技术的突破,都带来了电子设备革命性的发展。最近,我国在甲醇燃料电池的相关技术上获得了新突破,原理如下图1所示。
(1)请写出从C口通入O2发生的电极反应式 。
(2)以石墨做电极电解饱和食盐水,如下图2所示。电解开始后在 的周围(填“阴极”或“阳极”)先出现红色。假设电池的理论效率为80%(电池的理论效率是指电池产生的最大电能与电池反应所释放的全部能量之比),若消耗6.4g甲醇气体,外电路通过的电子个数为 (保留两位有效数字,NA取6.02×1023)。

Ⅱ.随着电池使用范围的日益扩大,废旧电池潜在的污染已引起社会各界的广泛关注。
(1)电池生产企业排放的工业废水中常含有Cu2+等重金属离子,直接排放会造成污染,目前在工业废水处理过程中,依据沉淀转化的原理,常用FeS等难溶物质作为沉淀剂除去这些离子。已知室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2。请用离子方程式说明上述除杂的原理 。
(2)工业上为了处理含有Cr2O72-的酸性工业废水,用绿矾(FeSO4·7H2O)把废水中的六价铬离子还原成三价铬离子,再加入过量的石灰水,使铬离子转变为Cr(OH)3沉淀。
①氧化还原过程的离子方程式为 。
②常温下,Cr(OH)3的溶度积Ksp=1×10-32 mol4·L-4,溶液的pH至少为 ,才能使Cr3+沉淀完全。
③现用上述方法处理100m3含铬(+6价)78mg•L-1的废水,需用绿矾的质量为 kg。(写出主要计算过程)
查看答案和解析>>
科目:高中化学 来源:2013届黑龙江省高二上学期期中考试化学(理)试卷 题型:填空题
(14分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注
⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g)
△H=-49.0kJ/mol
CH3OH(g)+H2O(g)
△H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。

①反应开始到平衡,H2的平均反应速率v(H2)=_____mol/(L·min)。H2的转化率为 。
②下列措施中能使n(CH3OH)/n(CO2)增大的是___________。[来源:]
A、升高温度 B、充入He(g),使体系压强增大
C、将H2O(g)从体系中分离 D、再充入1mol CO2和3mol H2
E、使用催化剂 F、缩小容器体积
⑵①反应进行到3分钟时,同种物质的v正 与v逆的关系: v正 v逆 (填>,=,<)
②上述反应平衡常数的表达式为 ,经计算该温度下此反应平衡常数的数值为 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年湖北省部分重点中学高二上学期期中联考化学试卷 题型:填空题
(14分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。
为探究反应原理,现进行如下实验,在体积为1 L的 密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)
密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol
CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率υ(H2)=__________mol/(L·mi n)。
n)。
②该反应的平衡常数表达式为K=__________。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1277 kJ·mol-1
ΔH=-1277 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1
③C(s)+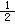 O2(g)=CO(g) ΔH=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH=-110.5 kJ·mol-1
④H2O(g)=H2O(l) ΔH=-44 kJ·mol-1
则,CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH=________kJ·mol-1。
(3)2009年10月 ,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如下图所示。
,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如下图所示。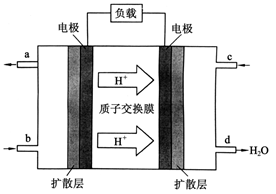
①该电池工作时,b口通入的物质为___________,c口通入的物质为___________。
②该电池负极的电极反应式为:_________________。
③工作一段时间后,当外电路中有1.2NA个电子通过时,有 g甲醇参加反应。
(4)在下列选项中与甲醇互为同系物的是_______(填字母代号),该同系物与相对分子质量相同的羧酸反应的化学方程式为______________,该反应的反应类型是____________。
试写出一种与D选项互为同分异构体且含有苯环的物质_______________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年黑龙江省牡丹江一中高二上学期期中考试化学(理)试卷 题型:填空题
(14分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注
⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①反应开始到平衡,H2的平均反应速率v(H2)=_____mol/(L·min)。H2的转化率为 。
②下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1mol CO2和3mol H2 H2 |
 同种物质的v正与v逆的关系: v正 v逆 (填>,=,<)
同种物质的v正与v逆的关系: v正 v逆 (填>,=,<)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com