
海水中主要含有Na+、K+、Mg2+、Ca2+、Cl-、Br-、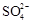 、
、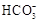 、
、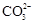 等离子,火力发电时排放的烟气可用海水脱硫,其工艺流程如下图所示:
等离子,火力发电时排放的烟气可用海水脱硫,其工艺流程如下图所示:
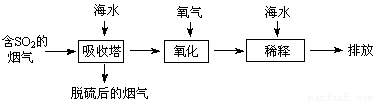
下列说法错误的是
A.海水pH约为8的原因主要是天然海水含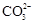 、
、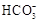
B.吸收塔中发生的反应有SO2+H2O H2SO3
H2SO3
C.氧化主要是氧气将 、
、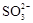 、H2SO3氧化为
、H2SO3氧化为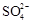
D.经稀释“排放”出的废水中,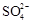 浓度与海水相同
浓度与海水相同
D
【解析】
试题分析:A、海水中主要含有Na+、K+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO-3等离子,在这些离子中能发生水解的是CO32-、HCO-3离子,CO32-+H2O⇌HCO3-+OH-,HCO3-+H2O⇌H2CO3+OH-它们水解呈碱性,所以天然海水的pH≈8,呈弱碱性,故A正确;B、天然海水吸收了含硫烟气后,要用O2进行氧化处理,因为氧气具有氧化性,被氧化的硫元素的化合价为+4价,具有还原性,所以氧气将H2SO3、HSO3-、SO32-等氧化为硫酸,如亚硫酸被氧化的反应为2H2SO3+O2=2H2SO4,故B正确;C、氧化后的“海水”需要用大量的天然海水与之混合后才能排放,是因中和稀释经氧气氧化后海水中生成的酸(H+),故C正确;
D、从框图可知:排放”出来的海水,是经过加天然海水中和、稀释经氧化后海水中生成的酸后排放的,溶液的体积显然比进入吸收塔的天然海水大,所以SO42-的物质的量浓度排放出来的海水中浓度小,故D错误。
考点:海水资源及其综合利用;二氧化硫的化学性质


 特高级教师点拨系列答案
特高级教师点拨系列答案 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
 下列说法错误的是( )
下列说法错误的是( )查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
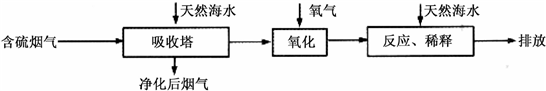
| 难溶电解质 | AgI | AgOH | Ag2S | pbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 硫酸被称为“工业之母”,足见其在工业生产中的重要地位.利用催化氧化反应将SO2转化为SO3是工业生产硫酸的关键步骤.一定温度下,向一个带活塞的体积为2L的密闭容器中充入2.0mol SO2(g)和1.0mol O2(g),发生反应:SO2(g)+
硫酸被称为“工业之母”,足见其在工业生产中的重要地位.利用催化氧化反应将SO2转化为SO3是工业生产硫酸的关键步骤.一定温度下,向一个带活塞的体积为2L的密闭容器中充入2.0mol SO2(g)和1.0mol O2(g),发生反应:SO2(g)+| 1 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、海水pH约为8的原因主要是天然海水含CO32-、HCO3- | B、吸收塔中发生的反应有SO2+H2O?H2SO3 | C、氧化主要是氧气将HSO3-、SO32-、H2SO3氧化为SO42- | D、经稀释“排放”出的废水中,SO42-浓度与海水相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 难溶电解质 | Cu(OH)2 | CuS | Pb(OH)2 | PbS | Ksp | 4.8×10-20 | 6.3×10-36 | 1.2×10-15 | 1.0×10-28 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com