
【题目】某二价金属跟HNO3反应时,金属与HNO3所消耗的物质的量之比为2∶5,则反应中唯一的还原产物是( )
A. NH3 B. NO2 C. N2O D. NO
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z是三种常见元素的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如图的转化关系,下列说法正确的是( )

A. X、Y、Z一定是非金属单质
B. 若X、Y都为金属单质,则Z必为非金属单质
C. X、Y、Z中至少有一种是金属单质
D. 如果X、Y都为非金属单质,则Z必为金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于一些重要的化学概念,下列叙述正确的是
A.根据丁达尔现象可以将分散系分为溶液、胶体和浊液
B.CO2、NO2、Mn2O7、P2O5 均为酸性氧化物
C.漂白粉、水玻璃、铝热剂均为混合物
D.熔融状态下,CH3COOH、NaOH、MgCl2 均能导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应式为:
3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
下列叙述不正确的是
A. 放电时负极的反应为:Zn-2e-+2OH-![]() Zn(OH)2
Zn(OH)2
B. 充电时阳极反应为:Fe(OH)3-3e-+5OH-![]() FeO42-+4H2O
FeO42-+4H2O
C. 放电时每转移3 mol电子,正极有1 mol K2FeO4被还原
D. 放电时正极附近溶液的碱性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙酸、乙醇、浓硫酸制取乙酸乙酯,加热蒸馏后,在饱和Na2CO3溶液的液面上得到无色油状液体,下列叙述正确的是( )
A. 浓硫酸与乙醇发生反应
B. 乙醇可以全部反应
C. 反应前的混合液中应加入碎瓷片
D. 导气管口应插入液面以下
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如下图所示(a、b为石墨电极),下列说法正确的是

A. 电池工作时,正极反应式为O2+2H2O+4e-=4OH-
B. 电解时,电子流动路径是:负极![]() 外电路
外电路![]() 阴极
阴极![]() 溶液
溶液![]() 阳极
阳极![]() 正极
正极
C. 试管中NaOH溶液是用来吸收电解时产生的Cl2
D. 忽略能量损耗,当电池中消耗2.24L(标准状况)H2时,b极周围会产生0.1mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某冶金厂的矿渣含有较多的Al2O3、Fe2O3、MgO、SiO2,现欲进行综合利用以提取氧化铝、氧化镁、氧化铁作为工业原料,其设计的工艺流程如下:
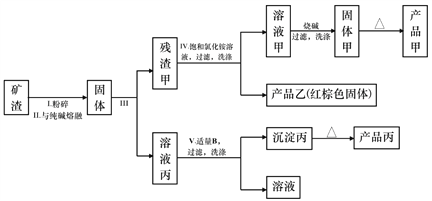
已知:
①硅酸的酸性比氢氧化铝强。
②饱和氯化铵溶液的pH约为5。
③氢氧化镁开始沉淀至沉淀完全的pH范围:9.0~12.0。
④氢氧化铁开始沉淀至沉淀完全的pH 范围:2.7~4.0。
回答下列问题:
(1)写出过程II中发生反应的化学方程式:_______________、_____________________。
(2)过程Ⅲ的名称是_______________;产品乙的俗名是_________________。
(3)过程V中所用适量的B是一种常见气体,过程V中所发生的反应的离子方程式为_______。
(4)残渣甲用饱和氯化铵溶液能部分溶解的原因是_______________(用离子方程式表示)。
(5)解释工业上不用电解产品甲制备相应金属单质的原因________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(CH2O)、乙酸(C2H4O2)和丙醛(C3H6O)组成的混合物中,氧元素的质量分数是37%,则碳元素的质量分数为
A. 27% B. 28% C. 54% D. 无法计算
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com