
��12�֣�����ѧһ���ʽṹ�����ʡ�
�������ʽṹ�����ʵĹ�ϵ����ش��������⣺
��1����̬��(Cr)ԭ�ӵļ۵����Ų�ʽ��________�������Ų�ʹ������ϵ������ͣ�ԭ����________��
��2����ˮ�д��ڶ�����ʽ������������롰����������ˮ������������ص�����ɱ�ʾΪ��_________������NH3�����м��Ǵ���H2O�еļ��ǵ�ԭ����_________ ��
��3�����и���ıȽ�����ȷ����_________��
| A����һ�����ܣ�Mg>Al | B���縺�ԣ�P>Ge |
| C���ȶ��ԣ�AsH3>H2S | D�������ԣ�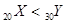 |
��12�֣�
��1��3d54s1��2�֣� 3d��4s����ϵĵ��Ӿ�Ϊ�����״̬��2�֣�
��2��O��H��N N��H��O��2�֣� NH3������Nԭ�Ӳ���sp3�ӻ���Nԭ�ӻ���һ�Թ¶Ե��ӣ���H2O������Oԭ�Ӳ���sp3�ӻ���Oԭ�������Թ¶Ե��ӣ��Գɼ����ӵ��ų����ø�ǿ��ʹ���Ǹ�С����2�֣�
��3��AB��2�֣�
��4��1:2��2�֣�
���������������1��CrΪ24��Ԫ�أ��۵����Ų�ʽ��3d54s1�����ݺ��ع�������Ų��ĵ���Ϊȫ����������ʱ��״̬�ȶ�����ϵ�������ͣ�Cr��̬ԭ��3d��4s����ϵĵ��Ӿ�Ϊ�����״̬������������ϵ������͡�
��2������������ˮ��NH3������H2O���Ӽ��γ���������ɱ�ʾΪ��O��H��N N��H��O��Nԭ���������5�����ӣ���3��Hԭ���γ�N��H����Nԭ�ӻ���һ�Թ¶Ե��ӣ���H2O�����У�Oԭ����2��Hԭ���γ�O��H���������Թ¶Ե��ӣ��Գɼ����ӵ��ų����ø�ǿ��ʹ���Ǹ�С��
��3��A��Mgԭ��2s����Ų�2�����ӣ�Ϊȫ����״̬�����Ե�һ�����ܣ�Mg>Al����ȷ��B������Ԫ�����ڱ����縺��P > Si��Si > Ge����P > Ge����ȷ��C���ȶ��ԣ� H2S > PH3 >AsH3������D��X������Ϊ20��ΪCa�� Y������Ϊ30��ΪZn��������Ca > Zn������
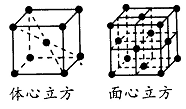
��4�������и����������������Fe��8��1/8+1=2����������������Fe��8��1/8+6��1/2=4����������������������������������ʵ�ʺ��е�Feԭ�Ӹ���֮��Ϊ��1:2��
���㣺���⿼������Ų��������Ԫ�������ɡ������ļ��㡣


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
X��Y��Z��W��Ԫ�����ڱ�ǰ�����ڳ���������Ԫ�أ�ԭ��������������X�ĵ��ʼ��ЦҼ��V�Цм�����X�ĵ�һ�����ܱ�������Ԫ�ض���Y�ĵ縺�Ա�X��С�����̬ԭ��������p�����Ǹò�s���ӵ�������Z��ǰ36��Ԫ����ԭ�Ӱ뾶��������Ԫ�أ�W��һ�ֺ��ص���������56����������30��
(1) Yλ��Ԫ�����ڱ���_______���ڵ�_______�壬W2+�ĺ�������Ų�ʽ��______��
(2) X��������XO2��H2O�Ƚϣ��۵�ϸߵ���_______ (�ѧʽ)��Z���⻯������ ���壬Z2O2�Ļ�ѧ��������_______(���ţ�
| A�����Ӽ� | B�����Թ��ۼ� | C���Ǽ��Թ��ۼ� | D�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��8�֣���֪A��B��C��D��E�Ƕ������е�5Ԫ�أ����ǵ�ԭ��������������A��ԭ�Ӱ뾶��С��Ԫ�أ�C��D��Ԫ�����ڱ��д������ڵ�λ�ã�Bԭ�ӵ��������������ڲ��������2����EԪ����DԪ��ͬ���壻E�ĵ���Ϊ��ɫ���壬�����ڶ���̼���ش��������⣺
��1��Ԫ��D�����ڱ��е�λ���� ��
��2������E�������ӵĽṹʾ��ͼ�� ��
��3��д��һ����A��B��C��D����Ԫ����ɵ����ӻ�����Ļ�ѧʽ�� ��
д��һ����A��C��D����Ԫ����ɵĹ��ۻ�����Ļ�ѧʽ�� ��
��4����9 g B������������D������ȼ�գ���������ͨ��1 L 1 mol��L��1NaOH��Һ�У�
��ȫ���պ���Һ�д������ڵ��������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
ǰ������ԭ���������������Ԫ��A��B��C��D�У�A��B�ļ۵��Ӳ���δ�ɶԵ��Ӿ�ֻ��1����ƽ��A����B+�ĵ������Ϊ8����Bλ��ͬһ���ڵ�C��D�����Ǽ۵��Ӳ��е�δ�ɶԵ������ֱ�Ϊ4��2����ԭ���������Ϊ2��
�ش��������⣺
��1��D2+�ļ۲�����Ų�ͼΪ_______��
��2������Ԫ���е�һ������С����________���縺��������________������Ԫ�ط��ţ�
��3��A��B��D����Ԫ����ɵ�һ��������ľ�����ͼ��ʾ��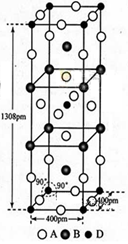
�ٸû�����Ļ�ѧʽΪ_________________��D����λ��Ϊ___________��
����ʽ����þ�����ܶ�_______g��cm-3��
��4��A-��B+��C3+����������ɵĻ�����B3CA6�����л�ѧ����������_________���û������д���һ���������ӣ������ӵĻ�ѧʽΪ________����λ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
�����ʽṹ�����ʡ�
��֪A��B��C��D��E����Ԫ�����ڱ���ǰ36�ŵ�Ԫ�أ����ǵ�ԭ��������������Aԭ�ӻ�̬ʱ���������������ڲ����������2����Bԭ�ӻ�̬ʱs��������P��������ȣ�C��Ԫ�����ڱ��ĸ�Ԫ���е縺�����D�Ļ�̬ԭ�Ӻ�����6���ܼ���ȫ���������ӣ�Eԭ�ӻ�̬ʱδ�ɶԵ�������ͬ����Ԫ�������ġ�
��1����̬Eԭ�ӵļ۵����Ų�ʽΪ ��
��2��AB32-�����幹���� ������Aԭ�ӵ��ӻ���������� ��
��3��A22-��B22+��Ϊ�ȵ����壬B22+�ĵ���ʽ�ɱ�ʾΪ ��1mol B22+�к��еĦм���ĿΪ ��
��4���������ʾʽд��C���⻯��ˮ��Һ�д��ڵ�������� ��
��5��������DC2�ľ����ṹ��ͼ��ʾ�������ӻ���Э������ܶ�Ϊa g/cm3����������� ��ֻҪ������ʽ�������ӵ�������ֵΪNA��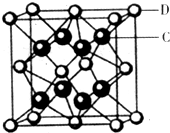
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
�±���Ԫ�����ڱ���һ���֡��������е���ĸ�ֱ����һ�ֻ�ѧԪ�ء�
| | | | |||||||||||||||
| | | | | | a | | b | | |||||||||
| | | c | | | d | e | | ||||||||||
| | | | | | | | | f | | g | | | | | | | |
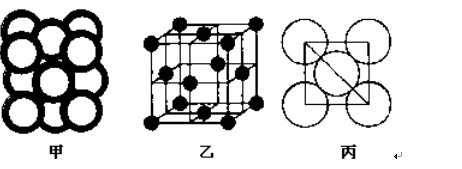
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��֪������ͭ��Һ�е��백�������ƣ�H2N��CH2��COONa�����ɵõ������A����ṹ����ͼ��
��1��CuԪ�ػ�̬ԭ�ӵ���Χ�����Ų�ʽΪ ��
��2��1mol�����������к��ЦҼ�����ĿΪ ��
��3�����������Ʒֽ����֮һΪ������̼��д��������̼��һ�ֵȵ����� ��д��ѧʽ������֪������̼��ˮ���ܽ�Ȳ���ȴ�����ڶ���̼�������ԭ�� ��
��4����������ӵĿռ乹��Ϊ ����֪������ͭ���տ�������һ�ֺ�ɫ���壬��ṹ����ͼ����û�����Ļ�ѧʽ�� ��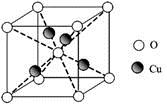
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�� 13�֣�����ı�����Ԫ�����ڱ���һ���֣����е���ĸ��Ӧ��ͬ��Ԫ�ء�
| A | | | |||||||||||||||
| | | | | M | Q | R | | | |||||||||
| | | E | | | | D | | ||||||||||
| | | | G | | | | J | | | | | | | | | | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���ڻ�ѧ���ĸ�����������ȷ���ǣ� ��
| A�������ӻ������ֻ�������Ӽ� | B���Ǽ��Լ�ֻ������˫ԭ�ӵĵ��ʷ����� |
| C�����ۻ������һ�����������Ӽ� | D����ͬԪ����ɵĶ�ԭ�ӷ����ֻ���ڼ��Լ� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com