解:(1)需十水合碳酸钠的质量为m=0.5L×0.05ol?L
-1×286g/mol=7.15g≈7.2g.
故答案为:7.2g.
(2)天平平衡原理为左盘内质量=右盘内质量+游码数值,所以实际称得碳酸钠晶体的质量为7g-0.2g=6.8g.
故答案为:6.8g.
(3)操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.
所用仪器有托盘天平、烧杯、玻璃棒、500mL容量瓶、胶头滴管、药匙.
根据提供仪器,所以还需仪器有500mL容量瓶、胶头滴管、药匙.
故答案为:500mL容量瓶、胶头滴管、药匙.
(4)a.未洗涤烧杯、玻璃棒,少量碳酸钠沾在烧杯壁与玻璃棒上,碳酸钠的实际质量减小,溶液浓度偏低;
b.定容时俯视刻度,导致溶液体积较小,所配溶液浓度偏高;
c.Na
2CO
3?10H
2O晶体已失去部分结晶水,实际碳酸钠的质量增大,所配溶液浓度增高.
分析:(1)利用n=cv计算出碳酸钠的物质的量,根据钠原子守恒可知碳酸钠与十水合碳酸钠的物质的量相等,再根据m=nM计算所需十水合碳酸钠的质量.
(2)天平平衡原理为左盘内质量=右盘内质量+游码数值,据此计算.
(3)根据配制溶液的实验操作过程选择所用仪器.
(4)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=
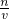
分析判断.
点评:本题考查了一定物质的量浓度溶液的配制,注意从c=
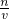
理解配制原理,注意碳酸钠晶体溶于水溶质为碳酸钠,托盘天平的精确度为0.1.

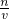 分析判断.
分析判断.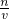 理解配制原理,注意碳酸钠晶体溶于水溶质为碳酸钠,托盘天平的精确度为0.1.
理解配制原理,注意碳酸钠晶体溶于水溶质为碳酸钠,托盘天平的精确度为0.1. 

 实验是进行化学研究的重要手段之一.请回答下列问题:
实验是进行化学研究的重要手段之一.请回答下列问题: