
【题目】将反应Cu(s)+2Ag+(aq)![]() Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是
Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是
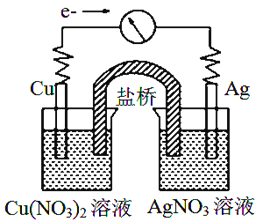
A. KNO3盐桥中的K+移向Cu(NO3)2溶液
B. 工作一段时间后,AgNO3溶液中c(Ag+)减小
C. 电子由AgNO3溶液通过盐桥移向Cu(NO3)2溶液
D. Cu作负极,发生还原
 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】已知:工业上煅烧石灰石的原理为:CaCO3![]() CaO+CO2↑,再让生石灰与水反应制得熟石灰。下列有关叙述不正确的是( )
CaO+CO2↑,再让生石灰与水反应制得熟石灰。下列有关叙述不正确的是( )
A. 碳酸钙、氧化钙是离子化合物,二氧化碳是共价化合物
B. 碳酸钙既含离子键又含共价键,氧化钙只含离子键
C. 生石灰与水生成熟石灰的反应中,既有离子键和共价键断裂,又有离子键和共价键生成
D. 二氧化碳既含极性共价键,又含非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,所使用的装置(夹持装置略)、试剂和操作方法有错误的是

A. 观察Fe(OH)2的生成
B. 除去CO中的CO2
C. 配制一定物质的量浓度的NaNO3溶液
D. 25 mL滴定管读数为11.80 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是

A. 水合铜离子的模型如图1所示,1个水合铜离子中有4个配位键
B. CaF2晶体的晶胞如图2所示,每个CaF2晶胞平均占有4个Ca2+
C. H原子的电子云图如图3所示,H原子核外电子在原子核附近做圆周运动
D. 金属Cu中Cu原子堆积模型如图4所示,该金属晶体为最密堆积,每个Cu原子的配位数均为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。

(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①检验滤液B中是否还含有铁元素的方法为:_______________(注明试剂、现象)。
②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为__________(填代号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
③由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边___________________(填操作名称)、过滤、洗涤。
④高铁酸钠(Na2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与漂白液(主要成分NaClO)在强碱性条件下反应可制取Na 2FeO4,反应的离子方程式为___________________________。
(2) ①SiO2和NaOH焙烧制备硅酸钠,可采用的装置为_______________(填代号)。

②过量CO2通入到硅酸钠的溶液中,然后加热蒸干,再高温灼烧,最后所得固体成分___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为短周期元素,在周期表中所处的位置如下图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。

(1)写出A、B、C三种元素的名称分别为__________、_________、__________;
(2)B位于元素周期表中第______周期,第______族;
(3)C的原子结构示意图为___________,C的单质与水反应的化学________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家屠呦呦因发现青蒿素治疗疟疾新疗法而获得2015年诺贝尔生理学或医学奖,已知青蒿素的结构简式如下。下列说法不正确的是( )

A. 青蒿素的分子式为C15H20O5
B. 青蒿素难溶于水,能溶于NaOH溶液
C. 青蒿素分子中所有的碳原子不可能都处于同一平面内
D. 青蒿素可能具有强氧化性,具有杀菌消毒作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3·5H2O),俗称大苏打,是无色透明晶体,易溶于水,易被氧化。是一种重要的化工产品,临床上用于氰化物的解毒剂,工业上也用于纸浆漂白的脱氯剂。某兴趣小组在实验室用如下装置(夹持仪器略去)模拟硫代硫酸钠生产过程。

(1)仪器a的名称为_________。
(2)装置A中发生反应的化学方程式为_____________________________。
(3)为提高产品纯度,应使烧瓶C中Na2S和Na2CO3恰好完全反应,则烧瓶C中Na2S和Na2CO3物质的量之比为____________。
(4)装置B中盛有饱和NaHSO3溶液,装置B的作用是_________、__________。
(5)装置D用于处理尾气,可选用的最合理装置(夹持仪器已略去)为____(填序号)。

(6)反应终止后,烧瓶C中的溶液经蒸发浓缩、冷却结晶即可析出Na2S2O3·5H2O,其中可能含有Na2SO3、Na2SO4等杂质。为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,_____________,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
已知:Na2S2O3稀溶液与BaCl2溶液混合无沉淀生成。
限选试剂:稀HNO3、稀H2SO4、稀HCl、蒸馏水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com