
| A. | 聚氯乙烯膜具有塑性和弹性,可用作食品保鲜膜 | |
| B. | 乙醇能使蛋白质变性,可用75%的乙醇溶液作医疗消毒剂 | |
| C. | 油脂能发生皂化反应,可用热的烧碱溶液去除试管内壁油脂 | |
| D. | 淀粉能与单质碘发生显色反应,可用碘水鉴别淀粉和纤维素 |
分析 A.聚氯乙烯含有增塑剂,对人体有害;
B.乙醇能使蛋白质变性,可用于杀菌消毒能力;
C.油脂在碱性条件下水解程度较大;
D.淀粉遇碘变蓝色.
解答 解:A.一般用聚乙烯材料作食品保鲜膜,聚氯乙烯含有增塑剂,对人体有害,不能用作食品保鲜膜,故A错误;
B.乙醇能使蛋白质变性,可用于杀菌消毒能力,医疗消毒剂一般用75%的乙醇溶液,故B正确;
C.油脂在碱性条件下水解生成高级脂肪酸钠和甘油,为皂化反应,水解程度较大,可用热的烧碱溶液去除试管内壁油脂,故C正确;
D.淀粉遇碘变蓝色,可用碘水鉴别淀粉和纤维素,故D正确.
故选A.
点评 本题综合考查有机物的性质及应用,为高频考点,侧重于化学与生活的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:选择题

| A. | 用NH4C1和Ca(OH)2反应制取NH3 | B. | 用浓盐酸和MnO2反应制取C12 | ||
| C. | 用H2O2溶液和MnO2反应制取O2 | D. | 用浓硝酸与Cu反应制取NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Ca2+、Ag+ | B. | Ba2+、Ag+、Ca2+ | C. | Ag+、Ba2+、Ca2+ | D. | Ag+、Ca2+、Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
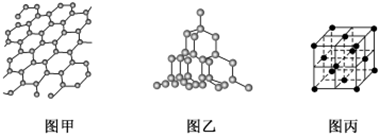
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔的结构简式:C2H2 | B. | 硫离子结构示意图: | ||
| C. | CaF2的电子式: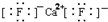 | D. | 中子数为10的氧原子:${\;}_8^{10}$O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40μg/m3 | B. | 80μg/m3 | C. | 100μg/m3 | D. | 160μg/m3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉 聚异戊二烯 | B. | 麦芽糖 胰岛素 | ||
| C. | 聚乙烯 酚醛树脂 | D. | 纤维素 涤纶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 酸与碱的中和反应 | |
| B. | 镁与盐酸的反应 | |
| C. | Ba(OH)2•8H2O与NH4Cl两种晶体混合搅拌 | |
| D. | 葡萄糖在生物体内氧化生成CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温下,5.6 g Fe与足量水蒸气完全反应失去电子数为3×6.02×1022 | |
| B. | FeCl3溶液蒸干、灼烧至恒重,最终剩余固体是FeCl3 | |
| C. | 电解精炼铜时,阳极泥中常含有金属金、银、锌等 | |
| D. | 向0.1 mol•L-1 氨水中加少量水,pH减小,c(OH-)/c(NH3•H2O)增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com