

| A. | CO2过度排放会导致温室效应 | |
| B. | 植物的光合作用有利于维持大气中O2和 CO2平衡 | |
| C. | 煤和石油的主要成分是有机物 | |
| D. | 碳循环过程中,碳元素均被氧化 |
分析 A.二氧化碳的排放,覆盖在地球表面,影响散热,导致地表温度升高;
B.光合作用吸收二氧化碳,释放氧气;
C.煤中主要含有碳元素,为有机物与无机物组成的混合物;石油是各种烷烃、环烷烃、芳香烃的混合物;
D.生物圈中的碳循环主要表现在绿色植物从空气中吸收二氧化碳,经光合作用转化为葡萄糖,并放出氧气,还涉及含碳的化合物之间可以相互转化,如碳酸的形成、碳酸的分解、碳酸钙和碳酸氢钙之间的转化等.
解答 解:A.二氧化碳过度排放会导致温室效应,应控制二氧化碳的排放,故A正确;
B.合作用吸收二氧化碳,释放氧气,则植物的光合作用有利于维持大气中O2和 CO2平衡,故B正确;
C.煤和石油的主要成分是有机物,故C正确;
D.生物圈中的碳循环中碳酸的形成、碳酸的分解、碳酸钙和碳酸氢钙之间的转化等都不涉及化合价的变化,碳元素不能被氧化,故D错误;
故选D.
点评 本题考查碳循环与物质的性质,为高频考点,把握发生的反应、物质的性质及环保问题为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:选择题
| A. | 天然油脂没有固定的熔、沸点 | |
| B. | 米饭在嘴中越咀嚼越甜的原因是淀粉水解生成甜味物质 | |
| C. | 油脂、乙醇是人体必需的营养物质 | |
| D. | 水果因含有酯类物质而具有香味 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
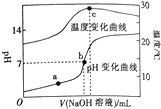 室温下,向20.00 mL 0.8mol•L-1一元酸HA溶液中滴入0.8 mol•L-1的NaOH溶液,溶液的pH和温度随加入NaOH溶液体积的变化曲线如图所示.下列有关说法正确的是( )
室温下,向20.00 mL 0.8mol•L-1一元酸HA溶液中滴入0.8 mol•L-1的NaOH溶液,溶液的pH和温度随加入NaOH溶液体积的变化曲线如图所示.下列有关说法正确的是( )| A. | 常温下,1.0 mol•L-1HA的溶液的pH=0 | |
| B. | a、b、c三点,a点混合溶液中c(Na+)最大 | |
| C. | a、b两点的溶液中水的离子积Kw(a)=Kw(b) | |
| D. | c点时消耗NaOH溶液的体积为20.00mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素a与氢元素能形成多种原子个数之比为1:1的化合物 | |
| B. | 元素b的单质不能与无水乙醇反应 | |
| C. | 元素c与元素d形成的化合物的水溶液呈碱性 | |
| D. | 元素a与元素d形成的化合物中肯定含有极性键,不可能含有非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
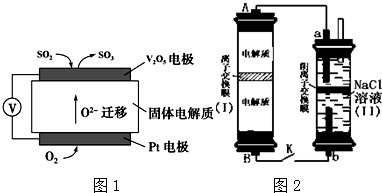
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,在制备乙醛的同时能获得电能,其总反应为:2CH2═CH2+O2→2CH3CHO.下列有关说法不正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,在制备乙醛的同时能获得电能,其总反应为:2CH2═CH2+O2→2CH3CHO.下列有关说法不正确的是( )| A. | 该电池可将化学能转化为电能 | |
| B. | 每有0.1 mol O2反应,则迁移0.4 mol H+ | |
| C. | 正极反应式为:CH2=CH2-2e-+2OH-═CH3CHO+H2O | |
| D. | 负极区溶液的pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
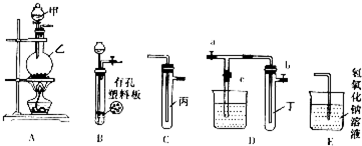
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有 较强的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
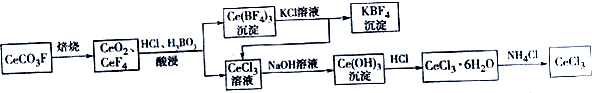
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com