
| A.温度升高20℃后,两溶液pH均不变 |
| B.加适量的醋酸钠晶体后,两溶液的pH均增大 |
| C.加水稀释2倍后,两溶液的pH同等程度减小 |
| D.加足量的锌充分反应后,两溶液中产生的氢气一样多 |


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源:不详 题型:单选题
| A.Na2CO3═2Na++CO32- | B.H2SO4═2H++SO42- |
| C.Ca(OH)2═Ca2++2(OH)- | D.FeCl3═Fe3++3Cl- |
| E.FeCl3═Fe3++3Cl- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
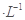 NaOH溶液中逐滴加入。0.2mol
NaOH溶液中逐滴加入。0.2mol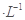 CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是
CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是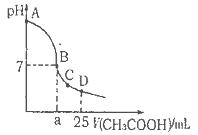
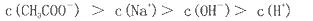
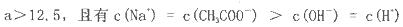
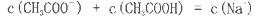
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
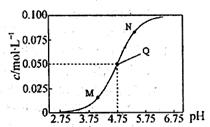
| A.该温度下醋酸的电离常数Ka为l0-4.75mol·L-l |
| B.M点所表示的溶液中: c(Na+)+c(H+)+c(CH3COOH)=0.1 mol·L-1 |
| C.N点所表示的溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
| D.Q点所表示的溶液中加入等体积的0.05mol·L-1NaOH溶液充分反应后pH>7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 编号 | A | B | C | D |
| 实验 装置 |  |  |  |  |
| 实验 目的 | 实验室模拟侯氏制碱法制备NH4HCO3 | 验证NH3易溶于水 | 制备银氨溶液 | 干燥NH3 |

| 实验步骤 | 实验目的 |
| 步骤1: ①用碱式滴定管取20.00ml 0.1mol/L 的氨水于锥形瓶中,加入几滴 。 ② 。 ③ ,停止滴定,记录数据。重复测定2-3次。 | 测定氨水的准确浓度。 |
| 步骤2: ; | ; |
| 步骤3:通过计算得出氨水的电离常数。 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Cl2(aq) K1=10-1.2
Cl2(aq) K1=10-1.2 HClO + H+ +Cl- K2=10-3.4
HClO + H+ +Cl- K2=10-3.4 H+ + ClO- Ka=?
H+ + ClO- Ka=?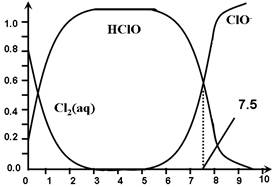
A.Cl2(g)+ H2O  2H+ + ClO- + Cl- K=10-10.9 2H+ + ClO- + Cl- K=10-10.9 |
| B.在氯处理水体系中,c(HClO) + c(ClO-) =c(H+)-c(OH-) |
| C.用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时差 |
| D.氯处理饮用水时,在夏季的杀菌效果比在冬季好 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶质的电离方程式为NaHCO3=Na++ H++ CO32- |
| B.25 ℃时,加水稀释后,n(H+)与n(OH-)的乘积变大 |
| C.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
| D.温度升高,c(HCO3-)增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

 ·L-1
·L-1 0.1mol·L-l
0.1mol·L-l查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com