
| ||
| ||
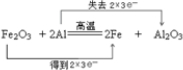 ,0.4mol Al参加反应时,转移的电子数目是1.2NA.
,0.4mol Al参加反应时,转移的电子数目是1.2NA. ;
; ,反应中,氧化性KMnO4>Cl2,Cl元素原子结构示意图为
,反应中,氧化性KMnO4>Cl2,Cl元素原子结构示意图为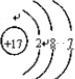 ,
, ;>;
;>; .
.

科目:高中化学 来源:不详 题型:单选题
| A.反应中O3是氧化剂,H2O和KI是还原剂 |
| B.在反应中,每消耗1molO3转移2mol电子 |
| C.氧化产物I2和还原产物O2的物质的量之比为1:1 |
| D.由此反应可知,氧化性强弱顺序为O3>I2>O2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2Na+2H2O=2NaOH+H2↑ | B.2F2+2H2O=4HF+O2 |
| C.CaO+H2O=Ca(OH)2 | D.Cl2+H2O=HCl+HClO |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na2O2是氧化剂,H2O是还原剂 |
| B.该反应中电子转移的数目为4e- |
| C.Na2O2既是氧化剂,又是还原剂 |
| D.O2既是氧化产物,又是还原产物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.从海水中提取溴 |
| B.通过雷电产生含氮化合物的高能固氮 |
| C.溶洞中石笋的形成 |
| D.常温下,浓硫酸与铁接触 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| ||
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com