
分析 第一份加入足量的烧碱并加热会产生在标准状况下为224mL气体证明含有NH4+,且物质的量为0.01mol;
第二份先加入足量的盐酸,无现象,则不含有CO32-,再加足量的BaCl2溶液,得固体2.33g,证明含有SO42-.,且物质的量为0.01mol,根据溶液呈电中性原理,判断是否含有NO3-,据此即可解答.
解答 解:第一份加入足量的烧碱并加热,因NH4++OH-═NH3↑+H2O,会产生标准状况下为224mL气体,证明含有NH4+,且物质的量为0.01mol;
第二份先加入足量的盐酸,无现象,则一定不含有CO32-,再加足量的BaCl2溶液,得固体2.33g,证明一定含有SO42-,且物质的量为:n=$\frac{2.33g}{233g/mol}$=0.01mol;
根据溶液中的电荷守恒,溶液呈电中性,则一定含有钾离子,且钾离子的浓度≥$\frac{0.01mol×2-0.01mol}{0.1L}$=0.1mol/L,所以该溶液中肯定含有NH4+、S042-、K+;
如果K+的物质的量等于0.01mol,则不含NO3-,如果K+的物质的量大于0.01mol,则还应含有NO3-;分析可知一定含有钾离子,肯定存在的离子有K+、NH4+ SO42-、NH4+,CO32-一定不存在,硝酸根离子可能存在,
(1)该溶液中肯定含有的离子是K+、NH4+ SO42-、NH4+,故答案为:K+、NH4+ SO42-、NH4+;
(2)该溶液中一定不含有的离子是CO32-,故答案为:CO32-;
(3)含有NH4+,且物质的量为0.01mol,含有SO42-,且物质的量为:n=$\frac{2.33g}{233g/mol}$=0.01mol;根据溶液中的电荷守恒,溶液呈电中性,则一定含有钾离子,如果有硝酸根,那么就大于0.1mol/L,如果没有硝酸根就刚好等于0.1mol/L,即钾离子的浓度≥$\frac{0.01mol×2-0.01mol}{0.1L}$=0.1mol/L,故答案为:是;含有NH4+,且物质的量为0.01mol,含有SO42-,且物质的量为:n=$\frac{2.33g}{233g/mol}$=0.01mol;根据溶液中的电荷守恒,溶液呈电中性,则一定含有钾离子;≥0.1mol/L.
点评 本题考查了溶液中成分的鉴别,离子性质的分析判断,依据物质的性质注意离子之间的反应以及现象是解答的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ②③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 粒子代码 | a | I | e |
| 原子核数 | 单核 | 四核 | 二核 |
| 粒子的电荷数 | 一个单位正电荷 | 0 | 一个单位负电荷 |

 .;
.; .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
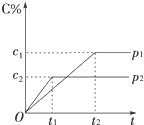 在一定温度下的可逆反应:mA(g)+nB(g)?pC(g)+qD(g),生成物C的体积分数与压强p1和p2、时间t1和t2的关系如图所示,则下列关系正确的是( )
在一定温度下的可逆反应:mA(g)+nB(g)?pC(g)+qD(g),生成物C的体积分数与压强p1和p2、时间t1和t2的关系如图所示,则下列关系正确的是( )| A. | p1>p2 | B. | p1=p2 | C. | m+n>p+q | D. | m+n<p+q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3NO2+H2═2HNO3+NO | B. | 4FeS2+11O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8SO2 | ||
| C. | 3Cl2+8NH3═N2+6NH4Cl | D. | 2Na+2NH3(液)═2NaNH2+H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
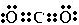 ,将其转变其他化工原料,必须破坏的化学键属于极性(填“极性”或“非极性”)键.
,将其转变其他化工原料,必须破坏的化学键属于极性(填“极性”或“非极性”)键.| 共价键 | H-H | H-F | H-Cl | H-Br | H-O | H-S | H-N | H-P |
| 键长(pm) | 74 | 92 | 127 | 141 | 98 | 135 | 101 | 321 |
| 键能(kJ/mol) | 436 | 568 | 432 | 368 | 464 | 364 | 391 | 142 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com