
| A.H2O、H2S、H2Se、H2Te的热稳定性依次减弱 |
| B.金刚石的熔沸点高于晶体硅 |
| C.NaF、NaCl、NaBr、NaI的熔点依次降低 |
| D.CH4、SiH4、GeH4、SnH4的沸点逐渐升高 |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
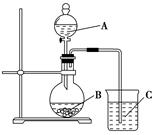
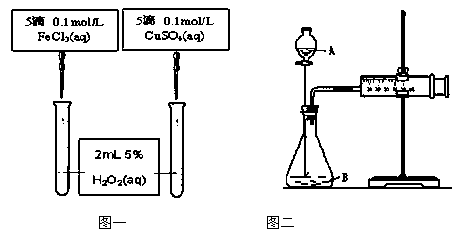
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
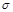 键数目为 。
键数目为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
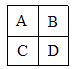
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 相关实验 | 预期目的 |
| A. | 把等质量的两份同种大理石块中的一份研成粉末,在同温度下分别与等体积同浓度的盐酸反应,观察放出气体快慢。 | 验证接触面积对化学反应速率的影响。 |
| B. | 在两份同浓度同体积的H2O2溶液中,分别加2滴FeCl3溶液和2滴CuCl2溶液,前者放在热水中,后者放在冰水中。观察气泡快慢; | 验证温度对化学反应速率的影响。 |
| C. | 常温下,直接将表面积相同的铝条和镁条投入同浓度同体积的稀盐酸中,观察产生气泡的速率。 | 比较同周期金属元素的金属性强弱。 |
| D. | 将纯Zn片与纯Cu片用导线连接,浸入到稀硫酸溶液中,观察气泡。 | 比较金属活泼性强弱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com