
����Ŀ��X��Y��Z��R��W��Ϊ���ڱ���ǰ�����ڵ�Ԫ�أ���ԭ��������������X2����Y+����ͬ�ĺ�������Ų���Z���⻯��ķе������һ����ͬ��Ԫ���⻯��ķе�ͣ�R�Ļ�̬ԭ����ǰ������Ԫ�صĻ�̬ԭ���е���������ࣻWΪ����Ԫ�أ�X��W�γɵ�ij�ֻ�������Z���⻯���Ũ��Һ����ʱ��Ӧ������ʵ������ȡZ����̬���ʣ��ش��������⣨��ػش����Ԫ�ط��ű�ʾ����
��1��R�Ļ�̬ԭ�ӵĺ�������Ų�ʽ�� ��
��2��Z���⻯��ķе������һ����ͬ��Ԫ���⻯��ķе�͵�ԭ���� ��
��3��X��Z�е縺�Խϴ���� �� Z��ij�ֺ������γ�����ʵ������X�ĵ��ʵ���ȡ����������ӵĿռ乹���� �� �������к��еĻ�ѧ�������� �� X��Z��X�ļ���109.5�㣮���������=������������ʾ���µ��Ӷ�֮��ij������µ��Ӷ���ɼ����Ӷ�֮��ij������ɼ����Ӷ�֮��ij�������
��4��X��Y�γɵĻ�����Y2X�ľ�����ͼ������X���ӵ���λ��Ϊ �� �����һ��X�������������Y����Ϊ���㹹�ɵļ�����Ϊ �� �û�������MgO��ȣ��۵�ϸߵ��� �� 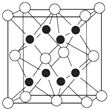
��5����֪�û�����ľ����߳�Ϊa pm����û�������ܶ�Ϊgcm��3 �� ��ֻҪ������ʽ�����ؼ������ֵ�������ӵ���������ֵΪNA��
���𰸡�
��1��1s22s22p63s23p63d54s1
��2��HF���Ӽ����γ��������HCl����֮�䲻�������
��3��O�������Σ����ۼ�����
��4��8�������壻MgO
��5��![]()
���������⣺X��Y��Z��R��W��Ϊ���ڱ���ǰ�����ڵ�Ԫ�أ���ԭ��������������R�Ļ�̬ԭ����ǰ������Ԫ�صĻ�̬ԭ���е���������࣬����R�ĺ�������Ų�ʽΪ1s22s22p63s23p63d54s1 �� Ϊ24�Ÿ�Ԫ�أ�x2����Y+����ͬ�ĺ�������Ų�������X��Y�ֱ�λ�ڵڢ�A��͢�A�壬��X��Y����һ���ڣ�����XY�ֱ�Ϊ�����ƣ�����ͼأ�X��W�γɵ�ij�ֻ�������Z���⻯���Ũ��Һ����ʱ��Ӧ������ʵ������ȡZ����̬���ʣ�X��Y��Z��ԭ��������С��24��Z���⻯��ķе������һ����ͬ��Ԫ���⻯��ķе�ͣ�˵��Z���ס������е�ijһ�֣����Ԫ�ػ�����֪ʶ��ʵ�����������ķ�������֪��XΪ��Ԫ�أ�WΪ��Ԫ�أ�ZΪ��Ԫ�أ���YΪ��Ԫ�أ���1������24��Ԫ�أ����Ļ�̬ԭ�ӵĺ�������Ų�ʽ��1s22s22p63s23p63d54s1 �� ���Դ��ǣ�1s22s22p63s23p63d54s1����2��HF���Ӽ����γ����������е�Ƚ�HCl�ߣ����Դ��ǣ�HF���Ӽ����γ��������HCl����֮�䲻�����������3�������Ⱥ������Դ��ڻ�����������������ԩ�2�ۿ�֪����Ԫ�صĵ縺�Դ�����Ԫ�أ�Z��ij�ֺ������γ�����ʵ������X�ĵ��ʵ���ȡ���˺�������Ϊ����أ������Ϊ�������ClO3������������ԭ�ӵļ۲���Ӷ���Ϊ�� ![]() =4���µ��Ӷ���Ϊ1������Cl�Ŀռ乹��Ϊ�����Σ�������ԭ�Ӻ���ԭ��֮���ǹ��ۼ������ݼ۲���ӶԻ������ۣ��µ��Ӷ��빲�õ��ӶԵ�֮��ij������ڹ��õ��Ӷ��빲�õ��Ӷ�֮��ij���������ClO3����O��Cl��O���ļ���С��109.50 �� ���Դ��ǣ�O�������Σ����ۼ���������4��ͼ�п�����ĸ���Ϊ
=4���µ��Ӷ���Ϊ1������Cl�Ŀռ乹��Ϊ�����Σ�������ԭ�Ӻ���ԭ��֮���ǹ��ۼ������ݼ۲���ӶԻ������ۣ��µ��Ӷ��빲�õ��ӶԵ�֮��ij������ڹ��õ��Ӷ��빲�õ��Ӷ�֮��ij���������ClO3����O��Cl��O���ļ���С��109.50 �� ���Դ��ǣ�O�������Σ����ۼ���������4��ͼ�п�����ĸ���Ϊ ![]() =4��ʵ����ĸ���Ϊ8�����Կ�������������ӣ�ʵ������������ӣ�����Na2O�ľ����ṹͼ��֪����������Χ����������Ӹ���Ϊ8���������һ�����������������������Ϊ���㹹�ɵļ�����Ϊ�����壬���������ӵİ뾶����þ���ӣ��������������еľ�����С������þ����������þ���۵���������ƣ����Դ��ǣ�8�������壻MgO����5�����ݾ�̯����֪����ÿ��Na2O�ľ����к�����������Ϊ8��������������Ϊ
=4��ʵ����ĸ���Ϊ8�����Կ�������������ӣ�ʵ������������ӣ�����Na2O�ľ����ṹͼ��֪����������Χ����������Ӹ���Ϊ8���������һ�����������������������Ϊ���㹹�ɵļ�����Ϊ�����壬���������ӵİ뾶����þ���ӣ��������������еľ�����С������þ����������þ���۵���������ƣ����Դ��ǣ�8�������壻MgO����5�����ݾ�̯����֪����ÿ��Na2O�ľ����к�����������Ϊ8��������������Ϊ ![]() =4������һ������������Ϊ
=4������һ������������Ϊ ![]() g��Na2O���ܶ�Ϊ��
g��Na2O���ܶ�Ϊ�� 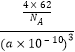 =
= ![]() ��
��
���Դ��ǣ� ![]() ��
��


 ��У��ҵ��ϵ�д�
��У��ҵ��ϵ�д� ���ɶ���ܲ��¿�ֱͨ��Уϵ�д�
���ɶ���ܲ��¿�ֱͨ��Уϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(��ѧʽΪCH3COOOH)��һ��ɱ��������ǿ��������������˵����ȷ���� ( )
A. ������������̼���⡢������Ԫ����ɵ�
B. ����������������������
C. �����������Է�������Ϊ60
D. ����������̼���⡢������Ԫ�ص�������Ϊ2��4��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����100mL��ı�����Һ�м���5mL������ֻ�Ϻ��ã�ʵ������Ϊ���� ��
A. Һ��ֲ㣬�²�Ϊ��ɫB. Һ��ֲ㣬�ϲ���ɫ
C. Һ��ֲ㣬�²���ɫD. �й����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����е����Ų�ʽ��ʾ�Ļ�̬ԭ���У���һ��������С����
A.ns2np3B.ns2np5C.ns2np4D.ns2np6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У����ܷ���ˮ�ⷴӦ�����ܷ����ӳɷ�Ӧ�������ܷ�����ȥ��Ӧ���ǣ� ��
A.CH2=CH��CH2CH2Cl
B.CH3CH2Cl
C.CH3Br
D.![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������100mL0.100mol/LNa2CO3��Һʱ�������в��裺���ܽ��ת�Ƣ۶��ݢܼ���ݳ�����ϴ�ӣ���ȷ��˳��Ϊ�� ��
A. �ݢܢ٢ޢڢ�B. �ݢܢڢ٢ޢ�
C. �ܢݢ٢ڢޢ�D. �ޢܢۢݢ٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����У��ڢ����͵ڢ����Ļ�ѧ��Ӧ�������õڢ��������ӷ���ʽ��ʾ���ǣ� ��
��� | �ڢ��� | �ڢ��� | �ڢ��� |
A | H2SO4��Һ�еμ�Ba��OH��2��ǡ�ó�����ȫ | ��NaHSO4��Һ�еμ�Ba��OH��2������ | H++SO |
B | ����������Һ��ͨ�����CO2 | ����������Һ�е������CO2 | OH��+CO2�THCO |
C | ��̼�������Һ�мӹ�������ʯ��ˮ | ��̼��������Һ�мӹ�������ʯ��ˮ | HCO |
D | FeBr2��Һ������Cl2��Ӧ | FeI2��Һ������Cl2��Ӧ | 2Fe2++Cl2�T2Fe3++2Cl�� |
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ѧ���ò;������Ƿ�������״������������Ч��ʩ֮һ�����п�ֱ���������ò;�����������
A.95%���Ҵ���ҺB.40%�ļ�ȩ��Һ
C.��������ϡ��ҺD.������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ�����ķ�չ�ͻ���Ҫ��IJ�����ߣ�CO2�IJ������ü�����Ϊ�о����ص㣮���������գ�
��1��Ŀǰ���ʿռ�վ����CO2��һ����Ҫ�����ǽ�CO2��ԭ�����漰�ķ�Ӧ����ʽΪ��
CO2��g��+4H2��g�� ![]() CH4��g��+2H2O��g��
CH4��g��+2H2O��g��
��֪H2������������¶ȵ����߶����ӣ����¶ȴ�300������400�棬���´ﵽƽ�⣬�ж����б����и��������ı仯�������������С�����䡱��
v�� | v�� | ƽ�ⳣ��K | ת���ʦ� |
��2����ͬ�¶�ʱ��������Ӧ�ڲ�ͬ��ʼŨ���·ֱ�ﵽƽ�⣬�����ʵ�ƽ��Ũ�������
[CO2]/molL��1 | [H2]/molL��1 | [CH4]/molL��1 | [H2O]/molL��1 | |
ƽ��� | a | b | c | d |
ƽ��� | m | n | x | y |
a��b��c��d��m��n��x��y֮��Ĺ�ϵʽΪ ��
��3��̼�H2CO3 �� Ki1=4.3��10��7 �� Ki2=5.6��10��11
���H2C2O4 �� Ki1=5.9��10��2 �� Ki2=6.4��10��5 0.1mol/L Na2CO3��Һ��pH0.1mol/L Na2C2O4��Һ��pH����ѡ����ڡ���С�ڡ����ڡ���
��Ũ�Ȳ�����Һ��̼����Һ�У�������Ũ�Ƚϴ���� ��
������Ũ�ȵIJ�����Һ��̼����Һ�������ϣ���Һ�и�������Ũ�ȴ�С��˳����ȷ���� �� ��ѡ���ţ�
a��[H+]��[HC2O4��]��[HCO3��]��[CO32��]b��[HCO3��]��[HC2O4��]��[C2O42��]��[CO32��]
c��[H+]��[HC2O4��]��[C2O42��]��[CO32��]d��[H2CO3]��[HCO3��]��[HC2O4��]��[CO32��]��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com