
准确移取20.00mL某待测HCl溶液于锥形瓶中,用0.1000mol·L-1NaOH溶液滴定,下列说法正确的是( )
A.滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定
B.随着NaOH溶液滴入,锥形瓶中溶液pH由小变大
C.用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定
D.滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小
【答案】B
【解析】滴定管用蒸馏水洗涤后,没有用标准液洗涤,装入NaOH溶液进行滴定会造成NaOH溶液的浓度变小,用量增多,结果偏大,A错;酸中滴入碱,溶液的碱性增强,酸性减弱,溶液pH由小变大,B对;用酚酞作指示剂,锥形瓶溶液开始是无色的,当锥形瓶中溶液由无色变红色,而且半分钟内不褪色时,证明滴定达到了滴定终点,C错;滴定达终点时,发现滴定管尖嘴部分有悬滴,造成碱的用量偏多,则测定结果偏大,D对。
【考点定位】本题主要考查了酸碱中和滴定的操作和误差分析。
【名师点睛】酸碱滴定前的操作主要有:检漏、洗涤、润洗、注液、赶气泡、调液。滴定过程中操作有左手控制滴定管的活塞 ,右手摇动锥形瓶 目视锥形瓶中溶液颜色的变化。指示剂的选择方法: 酸碱指示剂一般选用酚酞和甲基橙,石蕊试液由于变色不明显,在滴定时不宜选用,强酸与强碱滴定用 酚酞或甲基橙, 强酸与弱碱滴定用 甲基橙 ,弱酸与强碱滴定用 酚酞。终点的判断:溶液颜色发生变化且在半分钟内不再变色。酸碱中和滴定中的误差分析根据H+和OH—的物质的量相等,C标·V标= C待·V待,在讨论操作对标准液体积的影响,确定滴定误差。


 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
合成P(一种抗氧剂)的路线如下:
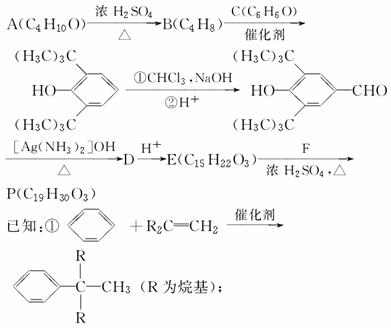
②A和F互为同分异构体,A分子中有三个甲基,F分子中只有一个甲基。
(1)A→B的反应类型为________。B经催化加氢生成G(C4H10),G的化学名称是________。
(2)A与浓HBr溶液一起共热生成H,H的结构简式为________。
(3)实验室中检验C可选择下列试剂中的________。
a.盐酸 B.FeCl3溶液
c.NaHCO3溶液 D.浓溴水
(4)P与足量NaOH溶液反应的化学反应方程式为_____________________________
________________________________________________________________________。(有机物用结构简式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.向0.1 mol·L-1 Na2CO3溶液中滴加酚酞,溶液变红色
B.Al3+、NO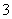 、Cl-、CO
、Cl-、CO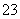 、Na+可以大量共存于pH=2的溶液中
、Na+可以大量共存于pH=2的溶液中
C.乙醇和乙酸都能溶于水,都是电解质
D.分别与等物质的量的HCl和H2SO4反应时,消耗的NaOH的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
氨基甲酸铵(H2NCOONH4)是一种白色固体,易水解、受热易分解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟制备氨基甲酸铵,反应的化学方程式如下:2NH3(g)+CO2(g) H2NCOONH4(s) △H<0
H2NCOONH4(s) △H<0
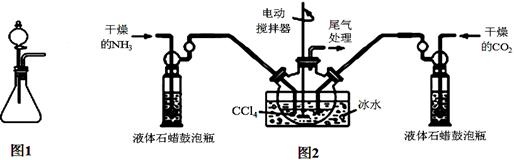
(注:四氯化碳与液体石蜡均为惰性介质)
(1)如用图1装置制取氨气,分液漏斗中的试剂名称是 。
(2)制备氨基甲酸铵的装置如图2所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
①发生器用冰水冷却的目的是 。
液体石蜡鼓泡瓶的作用是 。
 ②从反应后的混合物中分离出产品的实验方法是 (填操作名称)。为了得到纯净的产品,应采取的方法是 (填选项序号)。
②从反应后的混合物中分离出产品的实验方法是 (填操作名称)。为了得到纯净的产品,应采取的方法是 (填选项序号)。
a. 常压加热烘干 b. 高压加热烘干 c. 减压40 ℃以下烘干
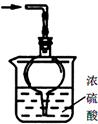
③尾气处理装置如右图所示。球形干燥管的作用: ;
浓硫酸的作用: 。
(3)取因部分变质而混有NH4HCO3的氨基甲酸铵样品15.64g,用足量石灰水充分处理后,使样品中所有碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为20 g。则样品中氨基甲酸铵的物质的量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,将0.05 mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质。有关结论正确的是( )
| 加入的物质 | 结论 | |
| A | 50mL 1 mol·L-1H2SO4 | 反应结束后,c(Na+)=c(SO42-) |
| B | 0.05molCaO | 溶液中 |
| C | 50mL H2O | 由水电离出的c(H+)·c(OH—)不变 |
| D | 0.1molNaHSO4固体 | 反应完全后,溶液pH减小,c(Na+)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9kJ·mol-1
NO(g)+1/2O2(g)=NO2(g) △H=-58.2kJ·mol-1
SO2(g)+O3(g)=SO3(g)+O2(g) △H=-241.6kJ·mol-1
(1)反应3NO(g)+O3(g)=3NO2(g)的△H=_______mol·L-1。
(2)室温下,固定进入反应器的NO、SO2的物质的量,改变加入O3的物质的量,反应一段时间后体系中n(NO)、n(NO2)和n(SO2)随反应前n(O3):n(NO)的变化见右图。
①当n(O3):n(NO)>1时,反应后NO2的物质的量减少,其原因是__________。
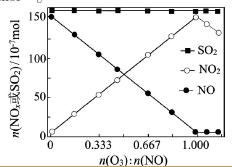 ②增加n(O3),O3氧化SO2的反应几乎不受影响,其可能原因是 _________。
②增加n(O3),O3氧化SO2的反应几乎不受影响,其可能原因是 _________。
(3)当用CaSO3水悬浮液吸收经O3预处理的烟气时,清液(pH约为 8)中SO32-将NO2转化为NO2-,其离子方程式为:___________。
(4)CaSO3水悬浮液中加入Na2SO4溶液,达到平衡后溶液中c(SO32-)=________[用c(SO42-)、Ksp(CaSO3)和Ksp(CaSO4)表示];CaSO3水悬浮液中加入Na2SO4溶液能提高NO2的吸收速率,其主要原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.Na与H2O的反应是熵增的放热反应,该反应能自发进行
B.饱和Na2SO4溶液或浓硝酸均可使蛋白质溶液产生沉淀,但原理不同
C.FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
 D.Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)
D.Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s) Mg2+(aq)+2OH—(aq),该固体可溶于NH4Cl溶液
Mg2+(aq)+2OH—(aq),该固体可溶于NH4Cl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为____________。
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中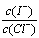 为:_____________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
为:_____________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)已知反应2HI(g) ===H2(g) + I2(g)的ΔH= +11kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为______________kJ。
(4)Bodensteins研究了下列反应:
2HI(g) H2(g) + I2(g)
H2(g) + I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0. | 0.773 | 0.780 | 0.784 |
① 根据上述实验结果,该反应的平衡常数K的计算式为:___________。
② 上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为________(以K和k正表示)。若k正 = 0.0027min-1,在t=40min时,v正=__________min-1
③ 由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为_________________(填字母)

查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是( )
A.在稀溶液中,1 mol酸和1 mol碱完全反应所放出的热量,叫做中和热
B.在101 kPa时,1 mol物质燃烧时所放出的热量叫做该物质的燃烧热
C.热化学方程式中,各物质前的化学计量数不表示分子个数
D.如果反应物所具有的总能量小于生成物所具有的总能量,则发生的反应是放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com