
我校环保兴趣小组在处理污水样品时,需用质量分数为36.5%的浓盐酸、密度为1.19 g/cm3?配制成250mL 0.1mol·L-1的盐酸溶液。
(1)在图所示仪器中,配制上述溶液不需要的是 (填右图相应仪器的序号); 除图中已有仪器外,配制上述溶液还需要的玻璃仪器是 ,其作用按使用的先后顺序分别是 和 。

(2)根据计算,下列量程或规格中,本实验量筒应使用的是_______;
A、10mL B、100mL C、250mL D、500mL
(3)在量取浓盐酸后,下列操作先后顺序是(用编号表示)
① 待稀释的盐酸温度与室温一致后,沿玻璃棒注入所选定规格的容量瓶中。
② 往容量瓶中小心加蒸馏水至液面接近环形刻度线1~2 cm处,改用胶头滴管加蒸馏水,使凹液面最低处与瓶颈的环形刻度线相切。
③ 在盛盐酸的烧杯中注入适量蒸馏水,并用玻璃棒搅动,使其混合均匀。
④ 用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
(4)在容量瓶的使用方法中,下列操作正确的是 。
A、使用容量瓶前检查它是否漏水
B、容量瓶用水洗净后,再用配好的稀HCl溶液润洗
C、配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线
D、配制溶液时,若试样是液体,用量筒取试样后直接倒入容量瓶中,缓慢加水至接近刻度线1 ~ 2cm处,用胶头滴管加蒸馏水至刻度线
E、盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀
(5)假设配制时其他操作均正确,只出现以下某一情况,试判断所配制的溶液浓度相比于要求的值(即0.1 mol/L)如何。(a、偏高;b、偏低;c、无影响,在下列横线上填相应序号)
①容量瓶中有少量蒸馏水
②烧杯和玻棒没有洗涤2-3次
③稀释浓HCl时,没有冷却就立即转移到容量瓶中
④配制的溶液装入洁净的但有少量蒸馏水的试剂瓶中
⑤若定容时俯视,所配溶液的物质的量浓度
科目:高中化学 来源:2016届山东省高三上学期期中模块测试化学试卷(解析版) 题型:选择题
近年来AIST报告正在研制一种“高容量、低成本”锂一铜空气燃料电池。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu20+H2O= 2Cu十2Li++20H-,下列说法不正确的是

A.放电时,Li+透过固体电解质向Cu极移动
B.放电时,负极的电极反应式为Cu20+H2O+2e-=Cu+2OH-
C.通空气时,铜被腐蚀,表面产生Cu20
D.整个反应过程中,铜相当于催化剂
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三上学期期中测试化学试卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式是
A.Fe2O3溶于过量氢碘酸溶液中: Fe2O3+6H++2I-=2Fe2++I2+3H2O
B.0.1 mol/L NH4Al(SO4)2溶液与0.2 mol/L Ba(OH)2溶液等体积混合:
Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O
C.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:
2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O
D.向次氯酸钠溶液中通入足量SO2气体: ClO-+SO2+H2O=HClO+HSO3-
查看答案和解析>>
科目:高中化学 来源:2016届浙江省嘉兴市高三上学期期中测试化学试卷(解析版) 题型:实验题
络氨铜【[Cu(NH3)4]SO4】是一种重要的染料及农药中间体。已知:①以氧化铜为主要原料合成该物质的合成路线如下图:
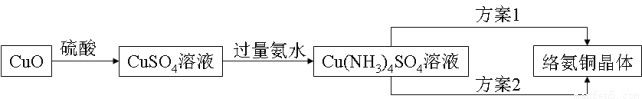
②络氨铜在乙醇-水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如下。
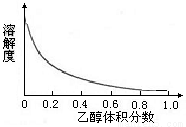
③(NH4)2SO4在水中可溶,在乙醇中难溶。
请根据以上信息回答下列问题:
(1)由CuO制出的CuSO4溶液中常含有 Fe2(SO4)3杂质,请设计一个可行方案,检验CuSO4溶液中是否含有Fe3+: 。
(2)[Cu(NH3)4]SO4 在水中存在如下解离过程:[Cu(NH3)4]SO4===[Cu(NH3)4]2+(深蓝色离子)+SO42-;[Cu(NH3)4]2+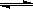 Cu2++4NH3。请写出在CuSO4溶液中逐滴加入氨水至过量的反应现象: 。
Cu2++4NH3。请写出在CuSO4溶液中逐滴加入氨水至过量的反应现象: 。
(3)①方案1的实验步骤为:加热蒸发→冷却结晶→过滤洗涤→干燥。该方案存在明显缺陷,因为得到的产物晶体往往含有Cu2(OH)2SO4杂质,产生该杂质的原因是 。
②方案2是较为理想的结晶方案,先向溶液C加入适量 (填物质名称),再过滤、洗涤、干燥即可得到较纯净的晶体。下列选项中,最适合作为滤出晶体洗涤液的是 。
A.乙醇 B. 蒸馏水 C.乙醇和水的混合液 D.饱和硫酸钠溶液
洗涤沉淀的操作方法是 。
(4)氨含量的测定:准确称取a g络氨铜样品,加入过量NaOH溶液微热,使NH3充分释放,并被准确量取的30.00mL 0.5000mol.L-1HCl溶液充分吸收。吸收液用0.1200mol·L-1的NaOH溶液滴定,消耗的NaOH溶液的体积为V L,则络氨铜样品中氨的质量分数为 (用含a、V的字母表达)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高一上学期10月月考化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.1 mol H2O的质量为18 g/mol
B.CH4的摩尔质量为16 g
C.3.01×1023个SO2分子的质量为32 g
D.标准状况下,1 mol任何物质体积均为22.4 L
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省台州市高一上学期第一次月考化学试卷(解析版) 题型:实验题
右图所示装置有多种用途,请回答下列问题:
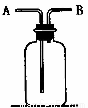
(1)洗气:除去CO中的水蒸气,装置内应盛放 ;
(2)检验:证明CO中混有CO2,装置内应盛放 ;
(3)集气:若用排空气法收集比空气轻的气体时,气体应从装置的 端通入(填“A” 或“B”,下同);若收集比空气重的气体,则气体从 端通入。若用排水法收集O2时,瓶内应先装满水,气体从 端通入。
(4)贮气:若要用水将装置中的氧气排出进行实验时,水应从 端通入。
(5)量气:若要测定实验室制得的少量O2的体积,则应在瓶内先装满水,再将O2从 端通入。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省台州市高二上学期第一次月考化学试卷(解析版) 题型:填空题
某学生利用下面实验装置探究盐桥式原电池的工作原理。按照实验步骤依次回答下列问题:
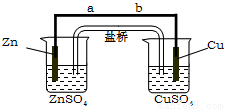
(1)导线中电子流向为__________(用a、b表示)。
(2)写出装置中锌电极上的电极反应式:_______________;
(3)若装置中铜电极的质量增加0.64 g,则导线中转移的电子数目为_____;(用“NA”表示)
(4)装置的盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向的表述正确的是________。
A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
C.盐桥中的K+、Cl-都向左侧烧杯移动
D.盐桥中的K+、Cl-几乎都不移动
(5)实验室用惰性电极电解200ml的硝酸银溶液一段时间后,撤去电源,若加入23.2g氧化银恰好使电解液恢复到原来状态,则电解过程中转移电子数为 mol;若加入25.0g氢氧化银恰好使电解液恢复到原来状态,则原硝酸银溶液的物质的量浓度为 mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西省高一上学期期中测试化学试卷(解析版) 题型:选择题
根据下列反应判断氧化剂的氧化性由强到弱的顺序正确的是
①Cl2+2KI═I2+2KCl
②2FeCl3+2HI═I2+2FeCl2+2HCl
③2FeCl2+Cl2═2FeCl3
④I2+SO2+2H2O═2HI+H2SO4.
A.Cl2>I2>Fe3+>SO2
B.Fe3+>Cl2>I2>SO2
C.Cl2>Fe3+>I2>SO2
D.Cl2>Fe3+>SO2>I2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省龙海市高二上学期期中测试化学试卷(解析版) 题型:选择题
右图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和稀盐酸,各加入生铁块,放置一段时间。下列有关描述错误的是

A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是:Fe-2e-=Fe2+
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com