
| 实验编号 | 起始浓度/(mol•L-1) | 反应后溶液的pH | |
| c(HA) | c(KOH) | ||
| 1 | 0.2 | 0.2 | >7 |
| 2 | a | 0.4 | 7 |
分析 ①等物质的量浓度等体积的HA和KOH混合,二者恰好反应生成KA,混合溶液pH>7,溶液呈碱性,说明KA是强碱弱酸盐,结合电荷守恒判断离子浓度大小;
②HA是弱酸、KOH是强碱,KA是强碱弱酸盐,其水溶液呈碱性,要使混合溶液呈酸性,则HA应该稍微过量.
解答 解:①等物质的量浓度且等体积的HA和KOH混合后,二者恰好反应生成KA,混合溶液pH>7,溶液呈碱性,说明KA是强碱弱酸盐,且c(H+)<c(OH-);由电荷守恒c(K+)+c(H+)=c(A-)+c(OH-),且溶液中存在c(H+)<c(OH-),所以c(K+)>c(A-),因为弱酸根离子水解程度很小,所以混合溶液中各离子浓度大小关系为c(K+)>c(A-)>c(OH-)>c(H+),
故答案为:c(K+)>c(A-)>c(OH-)>c(H+);
②HA是弱酸、KOH是强碱,KA是强碱弱酸盐,其水溶液呈碱性,要使混合溶液呈酸性,则HA应该稍微过量,且二者混合后溶液体积增大一倍,其浓度降低为原来的一般,结合物料守恒得c(A-)+c(HA)>0.2mol•L-1,
故答案为:>.
点评 本题主要考查了离子浓度大小比较,明确溶液中溶质及其性质是解本题关键,注意电荷守恒和物料守恒的灵活运用,注意:在第②问中易忽略两溶液等体积混合后,其体积变为原溶液体积的2倍,其浓度降为原来的一半,为易错点.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 42He原子核内含有2个质子 | |
| B. | 32He和42He互为同素异形体 | |
| C. | 32He原子核内含有2个中子 | |
| D. | 42He的最外层电子数为4,所以42He具有较强的金属性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F是中学化学常见的物质,它们之间转化关系如图所示.其中A、B为单质,F为白色沉淀,D为气体.
A、B、C、D、E、F是中学化学常见的物质,它们之间转化关系如图所示.其中A、B为单质,F为白色沉淀,D为气体.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
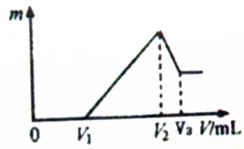 将0.1mol的镁、铝混合物溶于2mol/L H2SO4溶液中,然后再滴加0.1mol/L NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于2mol/L H2SO4溶液中,然后再滴加0.1mol/L NaOH溶液.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乳酸的相对分子质量是72 | |
| B. | 乳酸的分子式是C2H6O3 | |
| C. | 1mol乳酸和适量的金属钠可放出氢气44.8L(标准状况) | |
| D. | 1mol乳酸和少量的碳酸氢钠溶液反应可放出二氧化碳22.4L(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体 | |
| B. | 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液一定含有Fe2+ | |
| C. | 检验溶液中是否含有Fe3+:取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观察实验现象 | |
| D. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL 5%H2O2和1mL H2O,向另一支试管中加入2mL 5%H2O2和1mL FeCl3溶液,观察并比较实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-、Na+、NO3-、Ba2+ | B. | NH4+、HCO3-、Cl-、K+ | ||
| C. | K+、Ba2+、Cl-、SO42- | D. | Cu2+、NH4+、I-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将碘晶体中含有的少量沙子除去采用蒸馏的方法 | |
| B. | 蒸馏操作使用的温度计的水银球应插入到液体内 | |
| C. | 分离液体时,分液漏斗上的小孔与大气相通时打开活塞 | |
| D. | 若分液时不小心有少量上层液体流下来,补救措施是用滴管将其从烧杯中吸出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com