SO
2 是一种重要的化工原料,某兴趣小组采用如图1所示装置制取并探究SO
2气体的性质.
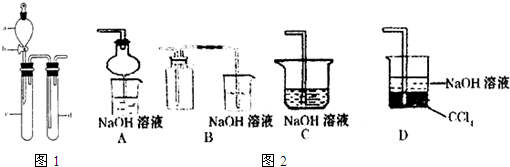
(1)下列实验方案适用于用如图所示装置制取所需SO
2 的是
B
B
(填序号).
A.Na
2SO
3 溶液与HNO
3 B.Na
2SO
3 固体与浓硫酸
C.固体硫在纯氧中燃烧
D.铜与浓H
2SO
4(2)组装完仪器后,检查发生装置气密性的方法是:关闭活塞b,
试管d中加水至浸没长导管口,(塞紧试管c和d的胶塞,)加热c(或用手捂热c),试管d中有气泡冒出,停止加热后,试管d中有一段水柱上升,说明装置气密性良好
试管d中加水至浸没长导管口,(塞紧试管c和d的胶塞,)加热c(或用手捂热c),试管d中有气泡冒出,停止加热后,试管d中有一段水柱上升,说明装置气密性良好
;
(3)指导老师指出应增加一尾气吸收装置,并帮助同学们设计了如图2所示装置,其中合理的是
AD
AD
(填序号).
(4)小组同学设计在试管d中加入FeCl
3溶液,验证SO
2 的还原性.为了验证SO
2 与Fe
3+发生了氧化还原反应,他们在通入足量SO
2 后,取试管d中的溶液,分成三份,并设计了如下实验:
方案A:往第一份试液中加入KMnO
4 溶液,紫红色褪去
方案B:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红
方案C:往第三份试液加入用稀盐酸酸化的BaCl
2,产生白色沉淀.
写出SO
2 与Fe
3+反应的离子方程式
2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
.
上述方案中不合理的一项是
A
A
,原因是
因为SO2和Fe2+都可以使KMnO4溶液褪色,所以无法确定一定有Fe2+生成
因为SO2和Fe2+都可以使KMnO4溶液褪色,所以无法确定一定有Fe2+生成
.



 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案


 (1)①要配制500mL 0.200mol?L-1的H2SO4溶液,需要的仪器除量筒、烧杯外还有
(1)①要配制500mL 0.200mol?L-1的H2SO4溶液,需要的仪器除量筒、烧杯外还有