
下列有关热化学方程式的叙述正确的是( )
|
| A. | 已知2H2 (g)+O2(g)═2H2O(g)△H=﹣483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol |
|
| B. | 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=﹣57.4kJ/mol |
|
| C. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 |
|
| D. | 已知C (s)+O2(g)═CO2(g)△H1;C(s)+1/2 O2(g)═CO(g)△H2,则△H1>△H2 |
| 热化学方程式.. | |
| 专题: | 化学反应中的能量变化. |
| 分析: | A、从燃烧热的定义来判断,燃烧热必须是生成稳定的氧化物. B、从中和热的定义来判断,中和热的热化学方程式必须让生成的水为1mol. C、从反应的吸放热角度能判断出石墨和金刚石的能量的高低,从而比较出稳定性. D、比较反应热的大小时要带着正负号比较. |
| 解答: | A、燃烧热指的是在25摄氏度,101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量.定义要点:物质必须是完全燃烧生成稳定的氧化物,即反应物中C→CO2,H2→H2O(l),S→SO2(g).故241.8kJ/mol不是氢气的燃烧热.故A错误. B、在稀溶液中,酸跟碱发生中和反应生成1 mol水时的反应热叫做中和热中和热.20.0gNaOH的物质的量n= C、由C(石墨,s)═C(金刚石,s)△H>0,可知反应吸热,即石墨的能量低于金刚石,而能量越低物质越稳定,故石墨比金刚石稳定,故C错误. D、反应 C(s)+O2(g)═CO2(g)△H1 ①和反应 C(s)+1/2 O2(g)═CO(g)△H2 ②均为放热反应,△H均小于0. 由于反应①是碳的完全燃烧,②是碳的不完全燃烧,故①放出的热量多于②,则△H1<△H2.故D说法正确. 故选B. |
| 点评: | 本题考查了燃烧热的概念、中和热的计算以及反应热的大小比较,较简单. |


科目:高中化学 来源: 题型:
恒温、恒压下,在一个容积可变的容器中发生如下反应:
N2(g) + 3H2(g)  2NH3(g)
2NH3(g)
(1)若开始时放入1mol N2和3 molH2,达到平衡后,生成a mol NH3,这时N2的物质的量为 mol;
(2)若开始时无NH3,只放入N2和H2,达到平衡时生成NH3的物质的量为3a mol,则开始时放入N2和H2的物质的量分别为 mol和 mol;
(3)若开始时放入x mol N2、6 molH2和2 molNH3,达到平衡后,N2和NH3的物质的量分别为y mol和3a mol,则x= ,y= ,平衡时H2的物质的量_____(选填一个编号)。
A.大于6 mol B.等于6 mol C.小于6 mol D.可能大于、小于或等于6 mol
作出判断的理由是 ;
(4)若在(3)的平衡混合物中,再加入6 molNH3,再次达到平衡后,NH3的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
钾是一种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应
制取。该反应为:Na(l)+ KCl(l)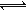 NaCl(l)+ K(g) ΔH>0 该反应的平衡
NaCl(l)+ K(g) ΔH>0 该反应的平衡
常数可表示为:K = C(K) 各物质的沸点与压强的关系见下表。
| 压强(kPa) | 13.33 | 53.32 | 101.3 |
| K的沸点(℃ ) | 590 | 710 | 770 |
| Na的沸点(℃ ) | 700 | 830 | 890 |
| KCl的沸点(℃ ) | 1437 | ||
| NaCl的沸点(℃ ) | 1465 |
(1)在常压下金属钾转变为气态从反应混合物中分离的最低温度约为 ,
而反应的最高温度应低于 ;
(2)在制取钾的过程中,为了提高原料的转化率可以采取的措施是
(任写一条);
(3)常压下,当反应温度升高至 900℃ 时,该反应的平衡常数可表示为:
K = 。
查看答案和解析>>
科目:高中化学 来源: 题型:
将十水碳酸钠与碳酸氢钠的混合物4.54g溶于水,配成100ml溶液.测得溶液中钠离子的物质的量浓度为0.4mol/L,在溶液中加入过量的盐酸,完全反应后,将溶液蒸干灼烧至质量不变,则所得固体的质量为( )
A 4.54g B 3.34g C 2.57g D 2.34g
查看答案和解析>>
科目:高中化学 来源: 题型:
在2A+B═3C+4D反应中,下面表示的化学反应速率最快的是( )
A.v(A)=0.5mol/(L•min) B.v(B)=0.05mol/(L•min)
C.v(C)=0.9mol/(L•min) D.v(D)=1.0mol/(L•min)
查看答案和解析>>
科目:高中化学 来源: 题型:
在足量锌与等物质的量浓度、等体积的盐酸和醋酸反应时,下列叙述正确的是( )
|
| A. | 开始反应时,二者的速率相等 | B. | 盐酸放出的H2多 |
|
| C. | 二者放出的H2一样多 | D. | 醋酸消耗的Zn的质量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:
MgSO4(s)+CO(g)⇌MgO(s)+CO2(g)+SO2(g)△H>0
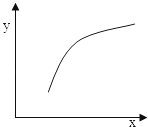
该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
| 选项 | x | y |
| A | 温度 | 容器内混合气体的密度 |
| B | CO的物质的量 | CO2与CO的物质的量之比 |
| C | SO2的浓度 | 平衡常数K |
| D | MgSO4的质量(忽略体积) | CO的转化率 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
“玉兔”号月球车用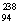 Pu作为热源材料。下列关于
Pu作为热源材料。下列关于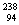 Pu的说法正确的是
Pu的说法正确的是
A.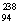 Pu与
Pu与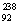 U互为同位素 B.
U互为同位素 B.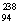 Pu与
Pu与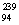 Pu互为同素异形体
Pu互为同素异形体
C.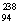 Pu与
Pu与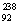 U具有相同的化学性质 D.
U具有相同的化学性质 D.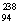 Pu与
Pu与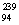 Pu具有相同的最外层电子数
Pu具有相同的最外层电子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com