
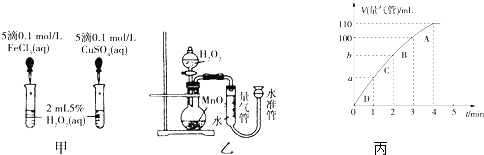
分析 (1)比较反应速率的大小可通过生成气泡的快慢来判断,比较金属阳离子的催化效果要排斥阴离子的干扰;
(2)①根据图象确定生成氧气的体积;
②根据图象斜率判断反应速率快慢;
③反应过程催化剂没变,但反应物的浓度降低,反应速率减小;
解答 解:(1)催化剂能改变化学反应的速率,这里是加快速率,若图1所示实验中反应速率为①>②,则一定说明氯化铁比硫酸铜催化效果好,因二者所含的阴离子不同,要证明Fe3+比Cu2+对H2O2分解催化效果好,还要使选择的试剂中阴离子种类相同,所以得出Fe3+和Cu2+对H2O2分解的催化效果,其结论不合理,故答案为:不合理;阴离子种类不同;
(2)①根据图象知,第4分钟时,随着时间的推移,气体体积不变,所以实验时放出气体的总体积是60 mL,故答案为:60;
②图象斜率的大小反映反应速率快慢,斜率越大,反应速率越快,将50mL H2O2一次性加入盛有0.10mol MnO2粉末的烧瓶中,由于反应物浓度减小,反应速率减小,3min~4min生成10mL气体,那么2min~3min生成气体的体积应大于10mL,故b小于90mL,故答案为:小于;
③在加入催化剂的条件下随着反应物浓度的降低,反应速率减小,故答案为:反应物浓度.
点评 本题考查了影响反应速率的因素,题目难度中等,解答须理清化学反应速率与催化剂间的关系以及速率与图象间的关系.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 过氧化钙的化学式是Ca2O2 | |
| B. | 1mol过氧化钠或过氧化钙跟足量水反应都生成0.5mol氧气 | |
| C. | 过氧化钙中阴阳离子数之比为2:1 | |
| D. | 过氧化钙中只含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 29g•mol-1 | B. | 29g | C. | 58g•mol-1 | D. | 58g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
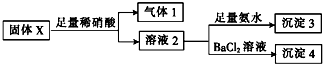
| A. | 气体1一定含NO可能含CO2 | |
| B. | 沉淀3一定含Mg(OH)2一定不含Al(OH)3 | |
| C. | 沉淀4可能为BaCO3、BaSO3或二者混合物 | |
| D. | 固体粉末X中一定有MgCl2和Na2SO3,可能有KAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 以石墨电极电解200mL CuSO4溶液,电解过程中电子转移物质的量n(e-)与产生气体体积V (g)(标准状况)的关系如图所示.下列说法中,正确的是( )
以石墨电极电解200mL CuSO4溶液,电解过程中电子转移物质的量n(e-)与产生气体体积V (g)(标准状况)的关系如图所示.下列说法中,正确的是( )| A. | 电解前CuSO4溶液的物质的量浓度为2mol/L | |
| B. | 电解后所得溶液中c(H+)=2mol/L | |
| C. | 当n(e-)=0.6mol时,V(H2):V(O2)=2:3 | |
| D. | 向电解后的溶液中加入16gCuO,则溶液可恢复为电解前的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有S2-、SO32-、Na+ | B. | 一定没有Ag+、Al3+ | ||
| C. | 可能只有Na+、S2-、CO32- | D. | 一定有Na+、S2-、NO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com