
| A. | 把金属铁放入稀硫酸中 2Fe+6H+=2Fe3++3H2↑ | |
| B. | 向Ca(ClO)2溶液中通入二氧化硫 Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO | |
| C. | 向Ca(HCO3)2溶液中加入足量的氢氧化钠溶液 Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| D. | 向NH4HSO4稀溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全:NH4++H++SO42-+Ba2++2OH-=NH3•H2O+BaSO4↓+H2O |
分析 A.二者反应生成二价铁离子;
B.次氯酸根离子具有强的氧化性,能够氧化二氧化硫;
C.氢氧化钠足量,反应生成碳酸钙、碳酸钠和水;
D.向NH4HSO4稀溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全,反应生成硫酸钡、一水合氨和水.
解答 解:A.把金属铁放入稀硫酸中,离子方程式:Fe+2H+=Fe2++H2↑,故A错误;
B.向Ca(ClO)2溶液中通入二氧化硫,二氧化硫被氧化成硫酸根离子,二氧化硫过量时,反应确的离子方程式为:Ca2++3ClO-+H2O+SO2═CaSO4↓+2HClO+Cl-,故B错误;
C.向Ca(HCO3)2溶液中加入足量的氢氧化钠溶液,离子方程式:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-,故C错误;
D.向NH4HSO4稀溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全,反应生成硫酸钡、一水合氨和水,离子方程式:NH4++H++SO42-+Ba2++2OH-=NH3•H2O+BaSO4↓+H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,侧重考查反应物用量对反应的影响,选项CD为易错选项.


科目:高中化学 来源: 题型:选择题
| A. | 达到平衡后,这个反应就停止,正反应速率等于逆反应速率且为0 | |
| B. | 最终可生成0.2 mol NH3 | |
| C. | 升髙温度,反应速率增大 | |
| D. | 当V正(N2):V 正(H2)=1:3时,一定达化学平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
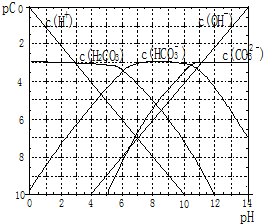 pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中该溶质的pC=-lg1×10-3=3.已知H2CO3溶液中存在的化学平衡为:CO2+H2O?H2CO3?H++HCO3-?2H++CO32-.如图为H2CO3溶液的pC-pH图.请回答下列问题:
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中该溶质的pC=-lg1×10-3=3.已知H2CO3溶液中存在的化学平衡为:CO2+H2O?H2CO3?H++HCO3-?2H++CO32-.如图为H2CO3溶液的pC-pH图.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁棒附近产生OH- | B. | 铁棒质量减少 | ||
| C. | 石墨棒上放出氯气 | D. | 石墨棒上放出氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | 0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
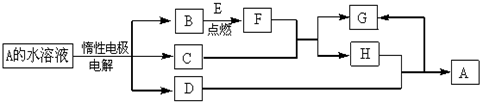
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷分子的比例模型示意图为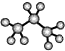 | |
| B. | 按系统命名法,(CH3)2CHCH(CH3)CH=CH2的名称为2,3-二甲基-4-戊烯 | |
| C. | 乙烯的结构简式:C2H4 | |
| D. | 乙醇的最简式:C2H6O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 四种短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y是地球上含量最高的金属元素.下列判断正确的是( )
四种短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y是地球上含量最高的金属元素.下列判断正确的是( )| A. | 1molW的单质在足量空气中燃烧转移电子数是6NA | |
| B. | 含Y元素的盐溶液可能显酸性,也可能显碱性 | |
| C. | Z元素的单质和氧化物不能与任何酸发生反应 | |
| D. | X与H、O元素形成的化合物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com