
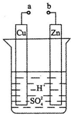
 原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:
原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:分析 (1)该装置构成原电池,锌易失电子作负极、Cu作正极,负极电极反应为Zn-2e-=Zn2+、正极反应为2H++2e-=H2↑,放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动;
(2)根据锌和转移电子之间的关系式计算;
(3)原电池反应必须是自发进行的放热的氧化还原反应;
(4)焓变与化学计量数成正比,正向为放热,逆向为吸热,同一个反应正向放出的热量与逆向吸收的热量数值相等,液态水转变为气态水要吸收热量.
解答 解:(1)该装置为原电池,锌易失电子作负极、Cu作正极,正极上氢离子放电,电极反应为2H++2e-=H2↑,锌失电子发生氧化反应,电解质溶液中氢离子向正极Cu极移动,故答案为:正;2H++2e-=H2↑;氧化;Cu;
(2)根据锌和转移电子之间的关系式得,消耗锌的质量=$\frac{0.2mol}{2}$=0.1mol,其质量为6.5g,故答案为:6.5;
(3)原电池反应必须是自发进行的放热的氧化还原反应,该反应是吸热反应且不是氧化还原反应,所以不能设计成原电池,故答案为:否;此反应为非氧化还原反应,且反应吸热;
(4)焓变与化学计量数成正比,正向为放热,逆向为吸热,同一个反应正向放出的热量与逆向吸收的热量数值相等,液态水转变为气态水要吸收热量,故答案为:同一个反应正向放出的热量与逆向吸收的热量数值相等,焓变与化学计量数成正比,液态水转变为气态水要吸收热量.
点评 本题考查了原电池原理及原电池设计,根据原电池反应特点、电极反应等知识点分析解答,铜锌原电池中电池反应式与锌发生化学腐蚀离子反应相同,题目难度不大.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:选择题
| 压强/MPa | ||||
| SO2平衡 | ||||
| 转化率/% | ||||
| 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
| A. | 0.1 MPa,400℃ | B. | 0.5 MPa,500℃ | C. | 1 MPa,600℃ | D. | 10 MPa,600℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3≤原子最外层电子数<8的元素一定是非金属元素 | |
| B. | 原子最外层只有2个电子的元素一定是第ⅡA族元素 | |
| C. | 最外层电子数比次外层电子数多的元素一定是第二周期元素 | |
| D. | 某元素的离子最外层电子数与次外层电子数相同,该元素一定位于第三周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +2H2O;
+2H2O;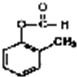 发生银镜反应的化学方程式:
发生银镜反应的化学方程式: +2Ag(NH3)2OH$\stackrel{水浴加热}{→}$
+2Ag(NH3)2OH$\stackrel{水浴加热}{→}$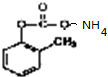 +2Ag↓+3NH3+H2O;
+2Ag↓+3NH3+H2O; 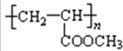 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与液溴在FeBr3催化下生成溴苯 | |
| B. | 乙醇在铜做催化剂的条件下,被空气中的氧气氧化成乙醛 | |
| C. | 乙烯使溴水褪色 | |
| D. | 乙酸与乙醇反应生成乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是化学变化 | B. | 没有能量变化 | ||
| C. | 有C-C、C-H键的断裂 | D. | 有C-C、C-H键的形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| pH | 2 | 4 | 6 | 6.5 | 8 | 13.5 | 14 |
| 腐蚀快慢 | 较快 | 慢 | 较快 | ||||
| 主要产物 | Fe2+ | Fe3O4 | Fe2O3 | FeO2- |
| A. | 在pH<4的溶液中,碳钢主要发生析氢腐蚀 | |
| B. | 在pH>6的溶液中,碳钢主要发生吸氧腐蚀 | |
| C. | 在pH>14的溶液中,碳钢腐蚀的正极反应为O2+4OH-+4e-═2H2O | |
| D. | 在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com