
| A.FeCl3 | B.FeCl2 | C.CuCl2 | D.FeS |
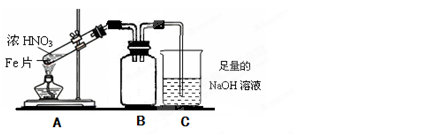

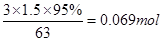 ,可能由于硝酸为热不稳定酸,易挥发,均可造成它的损耗
,可能由于硝酸为热不稳定酸,易挥发,均可造成它的损耗

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
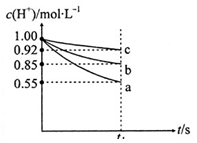
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
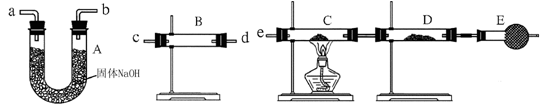
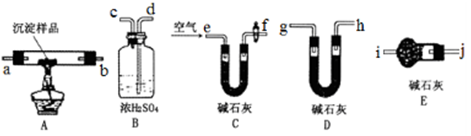
| 装置 | 所盛药品 | 实验现象 | 结论 |
| B | | | |
| C | CuO固体 | | |
| D | 无水CuSO4 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
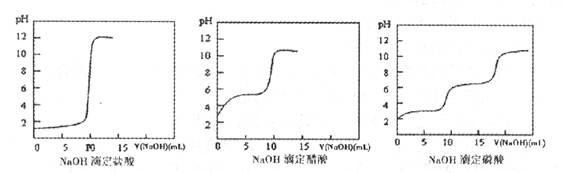
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
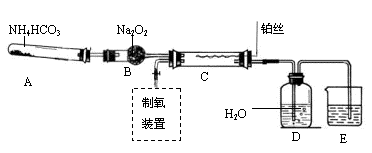
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
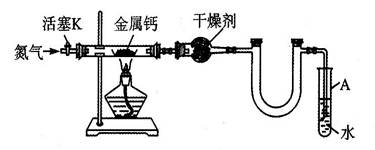
| 直玻管质量m0/g | 直玻管与钙的质量m1/g | 直玻管与产物的质量m2/g |
| 14.80 | 15.08 | 15.15 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| 实验 | 实验现象 | 结论 |
| A | 左边烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 活动性:Al>Fe>Cu |
| B | 烧瓶内颜色深浅不同 | 说明:2NO2 N2O4(g) △H<0 |
| C | 白色固体先变为淡黄色,后变为黑色 | 溶度积(Ksp):AgCl>AgBr >Ag2S |
| D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
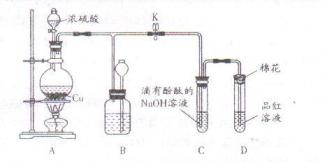
 直到反应完毕,最后发现烧瓶中还有铜片剩余。某同学根据所学的化学知识认为还有一定量的硫酸剩余。
直到反应完毕,最后发现烧瓶中还有铜片剩余。某同学根据所学的化学知识认为还有一定量的硫酸剩余。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com