
| A. | 元素最高化合价:Al>Mg | B. | 金属性:Al>Mg | ||
| C. | 酸性:H2SO4>H3PO4 | D. | 稳定性:HF>HCl |
分析 A.主族元素的最高正化合价等于其族序数;B.同一周期,原子序数越大,金属性越弱;C.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
D.元素的非金属性越强,对应的氢化物越稳定.
解答 解:A.主族元素的最高正化合价等于其族序数,Al族序数大于Mg,故A正确;B.Al与Mg处于同一周期,族序数Al>Mg,故金属性Mg>Al,故B错误;C.非金属性Cl>Br>I,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故C正确;
D.非金属性Cl>S>P,元素的非金属性越强,对应的氢化物越稳定,故D正确.
故选B.
点评 本题考查元素周期律知识,侧重于学生的分析能力和基本概念的理解和运用的考查,注意元素的性质与对应单质、化合物的关系,把握元素周期律的递变规律是解答该类题目的关键,难度不大.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:解答题
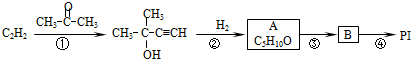
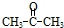 ”改为“乙醛”,经过②③④后得到产物的结构简式是
”改为“乙醛”,经过②③④后得到产物的结构简式是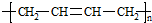 .
.

 +n NaOH→
+n NaOH→ +n CH3COONa.
+n CH3COONa.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某同学按如图所示的装置进行实验.A、B为两种常见金属,它们的硫酸盐可溶于水.当K闭合时,在交換膜处
某同学按如图所示的装置进行实验.A、B为两种常见金属,它们的硫酸盐可溶于水.当K闭合时,在交換膜处| A. | 反应初期,x电极周围出现白色胶状沉淀,不久沉淀溶解 | |
| B. | 溶液中(A2+)减小 | |
| C. | y电极上有H2产生,发生还原反应 | |
| D. | B的电极反应:B-2e═B2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石与碳纳米管互为同素异形体 | B. | N5与N2互为同素异形体 | ||
| C. | 14C的质子数为14 | D. | 乙醇和二甲醚属于同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
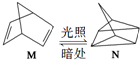 △H=+88.6kJ•mol-1
△H=+88.6kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:解答题
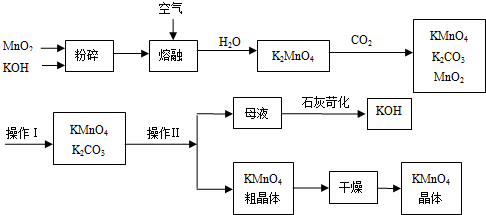
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2具有很强的氧化性,在化学反应中只能作氧化剂 | |
| B. | 液氨汽化时要吸收大量的热,可用作制冷剂 | |
| C. | 二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 | |
| D. | SO2和Cl2都有漂白作用,将等物质的量的两种气体同时作用于潮湿的有色物质时,可增强漂白作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | |
| B. | CH2=CH2+HBr→CH3CH2Br | |
| C. | 2CH3CH2OH+2Na→2 CH3CH2ONa+H2↑ | |
| D. | 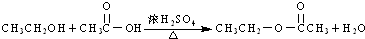 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com