
| A、①④ | B、②④ | C、③④ | D、④ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、α1>α2>α3 |
| B、α3>α2>α1 |
| C、α3>α1>α2 |
| D、α1>α3>α2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
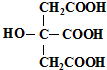
| A、柠檬酸中能发生酯化反应的官能团有2种 |
| B、1 mol柠檬酸可与4 mol NaOH发生中和反应 |
| C、1 mol柠檬酸与足量金属Na反应生成生成1.5mol H2 |
| D、柠檬酸与O2在Cu作催化剂,加热的条件下,能发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、用小苏打治疗胃酸过多:
| ||
B、用食醋除去水瓶中的水垢:
| ||
| C、漂白粉溶液中加入稀盐酸:H++ClO-=HClO | ||
| D、向澄清石灰水中通入过量的二氧化碳气体:Ca2++2OH-+CO2=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2是碱性氧化物,能与盐酸反应生成盐 | ||
| B、Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | ||
C、检测某溶液是否含有
| ||
| D、配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | CH2O | CH2O2 | CH4O | C2H6 | C2H4O | C2H4O2 | C2H6O |
| A、②⑤ | B、①③④ |
| C、③④ | D、②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH+HCl═NaCl+H2O |
| B、Cl2+H2O═HCl+HClO |
| C、CuSO4+BaCl2═BaSO4↓+CuCl2 |
| D、CaCO3+2HCl═CaCl2+H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com