
| A.H2S | B.CH4 | C.NH3 | D.H2O |
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案科目:高中化学 来源:不详 题型:单选题
| A.NO2、BF3、PCl3这三个分子中的所有原子最外层电子均未满足8电子稳定结构 |
| B.在干冰中,每个CO2分子周围有6个紧邻的分子 |
| C.在NaCl晶体中,Na+的配位数为6 |
| D.金属导电的实质是金属阳离子在外电场作用下的定向移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.直线形;三角锥形 | B.V形;三角锥形 |
| C.直线形;平面三角形 | D.V形;平面三角形 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CH4<H2O<HF<SiH4 | B.SiH4<HF<CH4<H2O |
| C.SiH4<CH4<H2O<HF | D.H2O<CH4<HF<SiH4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.同一种物质 | B.同分异构体 | C.同系物 | D.同素异形体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
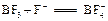 。写出硼酸与NaOH溶液反应的离子方程式: 。
。写出硼酸与NaOH溶液反应的离子方程式: 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com