
 cC(g);△H="Q" kJ/mol如图表示外界条件(温度、压强)的变化对上述反应的影响。下列判断正确的是( )
cC(g);△H="Q" kJ/mol如图表示外界条件(温度、压强)的变化对上述反应的影响。下列判断正确的是( )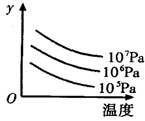
| A.a+b<c时,y轴表示平衡混合气中C的质量分数 |
| B.a+b>c时,y轴表示平衡混合气的平均摩尔质量 |
| C.Q > 0时,y轴表示达到平衡时B的转化率 |
| D.Q < 0时,y轴表示达到平衡时A的浓度 |
 cC(g),增大压强,平衡向左移动,所以y不能表示平衡混合气中C的质量分数,故A错误;若a+b>c时,则对于可逆反应aA(g)+bB(g)
cC(g),增大压强,平衡向左移动,所以y不能表示平衡混合气中C的质量分数,故A错误;若a+b>c时,则对于可逆反应aA(g)+bB(g) cC(g),增大压强,平衡向右移动,压强大,分子数就越少,故y轴表示平衡混合气的平均摩尔质量,故B正确,为本题的答案;若.Q > 0时,则可逆反应aA(g)+bB(g)
cC(g),增大压强,平衡向右移动,压强大,分子数就越少,故y轴表示平衡混合气的平均摩尔质量,故B正确,为本题的答案;若.Q > 0时,则可逆反应aA(g)+bB(g)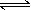 cC(g),为吸热反应,则y不能表示达到平衡时B的转化率,因为温度升高,平衡向右移动,B的转化率升高,与图相反,故C错误;Q < 0时,则可逆反应aA(g)+bB(g)
cC(g),为吸热反应,则y不能表示达到平衡时B的转化率,因为温度升高,平衡向右移动,B的转化率升高,与图相反,故C错误;Q < 0时,则可逆反应aA(g)+bB(g)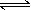 cC(g),为放热反应,温度升高平衡向左移动,所以温度越高,A的浓度越大,故D错误。
cC(g),为放热反应,温度升高平衡向左移动,所以温度越高,A的浓度越大,故D错误。

科目:高中化学 来源:不详 题型:单选题
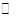 C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)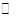 N2O4(g)ΔH<0的浓度(c)随时间(t)的变化情况。下列说法正确的是
N2O4(g)ΔH<0的浓度(c)随时间(t)的变化情况。下列说法正确的是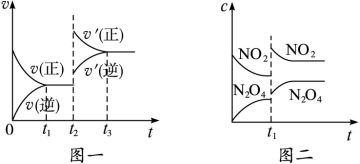
| A.图一的t2时刻和和图二的t1时刻改变的条件都有可能是升高了温度或增大了压强 |
| B.若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小 |
| C.图一表示在新条件下达到平衡时,v′(正)>v′(逆),图二表示在新条件下达到平衡时,v′(正)<v′(逆) |
| D.其它条件不变,分别使用不同催化剂上述反应的平衡常数均不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2AB(g)达到平衡状态的标志是 ( )
2AB(g)达到平衡状态的标志是 ( ) 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.2SO3(g)  2SO2(g)+02(g) 2SO2(g)+02(g) |
B.H2(g)+I2(g)  2HI(g) 2HI(g) |
C.C(s)+H2O(g)  C0(g)+H2(g) C0(g)+H2(g) |
D.N2(g)+3H2(g)  2NH3(g) 2NH3(g) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1,在800℃时的化学平衡常数K=1.0 。某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1,在800℃时的化学平衡常数K=1.0 。某时刻测得该温度下的密闭容器中各物质的物质的量见下表:| CO | H2O | CO2 | H2 |
| 0.5 mol | 8.5 mol | 2.0 mol | 2.0 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。| 压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.高锰酸钾(KMnO4)溶液加水稀释后颜色变浅 |
| B.使用催化剂,提高合成氨的生产效率 |
| C.新制的氯水在光照条件下颜色变浅 |
| D.H2、I2、HI平衡混合气体加压后颜色变深 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2HI(g)(HI为无色气体)已达平衡状态的是( )
2HI(g)(HI为无色气体)已达平衡状态的是( )| A.一个H-H键断裂的同时有两个H-I键形成 |
| B.v (H2)正= v (HI) 逆时的状态 |
| C.恒温恒容时,反应混合物总质量保持不变的状态 |
| D.恒温恒容时,体系的颜色不再发生变化的状态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com