
分析 该反应达到平衡状态时NH3的平衡转化率为50%,则参加反应的△n(NH3)=2mol×50%=1mol,2min内该反应的反应速率v(NH3)=$\frac{\frac{△n}{V}}{△t}$;
化学平衡常数K=$\frac{c({H}_{2}O)}{{c}^{2}(N{H}_{3}).c(C{O}_{2})}$;
根据方程式知,生成△n(H2O)=$\frac{1}{2}$△n(NH3)=0.5mol,参加反应的△n(CO2)=$\frac{1}{2}$△n(NH3)=0.5mol,
平衡时容器中c(NH3)=$\frac{1mol}{2L}$=0.5mol/L、c(CO2)=$\frac{0.5mol}{2L}$=0.25mol/L、c(H2O)=$\frac{0.5mol}{2L}$=0.25mol/L,利用平衡常数公式计算.
解答 解:该反应达到平衡状态时NH3的平衡转化率为50%,则参加反应的△n(NH3)=2mol×50%=1mol,2min内该反应的反应速率v(NH3)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{1mol}{2L}}{1min}$=0.25mol/(L.min);
化学平衡常数K=$\frac{c({H}_{2}O)}{{c}^{2}(N{H}_{3}).c(C{O}_{2})}$;
根据方程式知,生成△n(H2O)=$\frac{1}{2}$△n(NH3)=0.5mol,参加反应的△n(CO2)=$\frac{1}{2}$△n(NH3)=0.5mol,
平衡时容器中c(NH3)=$\frac{1mol}{2L}$=0.5mol/L、c(CO2)=$\frac{0.5mol}{2L}$=0.25mol/L、c(H2O)=$\frac{0.5mol}{2L}$=0.25mol/L,化学平衡常数K=$\frac{0.25}{(0.{5)}^{2}×0.25}$=4,
故答案为:0.25mol/(L.min);$\frac{c({H}_{2}O)}{{c}^{2}(N{H}_{3}).c(C{O}_{2})}$;4.
点评 本题考查化学平衡计算及反应速率计算,侧重考查学生分析计算能力,注意平衡常数计算时要用浓度而不是物质的量,为易错点.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸与氢氧化钡溶液混合产生沉淀:Ba2++SO${\;}_{4}^{2-}$=BaSO4↓ | |
| B. | 用大理石与稀盐酸制备二氧化碳:CO${\;}_{3}^{2-}$+2H+=CO2↑+H2O | |
| C. | 用氢氧化钠溶液吸收氯气:Cl2+2OH-=ClO-+Cl-+H2O | |
| D. | 铜片放入稀硝酸中产生气体:Cu+4H++2NO${\;}_{3}^{-}$=Cu2++2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
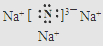 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲、乙、丙三种单质全是非金属 | |
| B. | 上述转化关系所涉及的化合物中有一种是电解质 | |
| C. | 上图所示的五个转化关系中,有三个是化合反应 | |
| D. | 上图所示的五个转化关系中,均为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
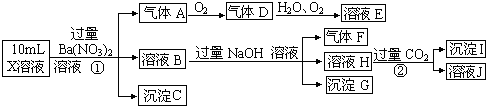
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 含1mol HPE的溶液最多可以和2molNaOH反应 | |
| B. | HPE不能跟浓溴水反应 | |
| C. | 1molHPE能与4molH2发生加成反应 | |
| D. | HPE分子中最多有12个原子共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用的NaOH固体在空气中敞口放置了一段时间 | |
| B. | 容量瓶用蒸馏水洗净后,未经干燥 | |
| C. | 在烧杯中溶解NaOH后,未经冷却即将溶液转入容量瓶 | |
| D. | 调节天平零点时未将游码回到最左边 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com