
下列递变规律正确的是:
| A.HClO4、H2SO4、H3PO4的酸性依次增强 |
| B.P、S、Cl最高正价依次升高 |
| C.HCl、HBr、HI的稳定性依次增强 |
| D.锂、钠、钾的金属性依次增强 |
BD
解析试题分析:A.元素的非金属性Cl>S> P。元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强。因此酸HClO4、H2SO4、H3PO4的酸性依次减弱。错误。B.P、S、Cl最外层电子数分别为5、6、7.元素的最高正价等于其元素原子的最外层电子数。所以P、S、Cl最高正价依次升高。正确。C.Cl、Br、I的非金属性逐渐减弱。元素的非金属性越强,其氢化物的稳定性就越强。所以HCl、HBr、HI的稳定性依次减弱。错误。D.锂、钠、钾是同一主族的元素,从上到下元素的原子半径逐渐增大,原子失去电子的能力逐渐增强,因此元素的金属性依次增强。正确。
考点:考查元素的构、位、性关系的知识。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:单选题
几种短周期元素的原子半径及某些化合价见下表。分析判断下列说法正确的是( )
| 元素代号 | A | B | D | E | G | I | J | K |
| 化合价 | –1 | –2 | +4 –4 | –1 | +5 –3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是( )
| A.Cl、Br、I的非金属性逐渐减弱,HCl、HBr、HI水溶液的酸性逐渐减弱 |
| B.短周期元素形成离子后,最外层均达8电子稳定结构 |
| C.多电子原子中,在离核较近的区域运动的电子能量较低 |
| D.Cl、 S、P得电子能力和它们相应的最高价氧化物对应水化物的酸性均依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列各组物质的性质比较,正确的是
| A.酸性:HClO4>H3PO4>H2SO4 |
| B.氢化物稳定性:H2S>HF>H2O |
| C.碱性:Al(OH)3>Mg(OH)2>NaOH |
| D.氧化性:F2 > Cl2 > Br2 > I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
科学家对原子结构的认识顺序正确的是
①道尔顿原子模型;②汤姆生原子模型;③卢瑟福原子模型;④电子云模型
| A.①③②④ | B.④①②③ | C.①②③④ | D.④②③① |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法中,不符合ⅦA族元素性质特征的是
| A.从上到下原子半径逐渐减小 | B.易形成-1价离子 |
| C.最高价氧化物的水化物显酸性 | D.从上到下氢化物的稳定性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知
| W | X | |
| | Y | Z |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是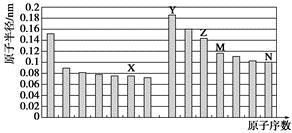
| A.Z、N两种元素的离子半径相比,前者较大 |
| B.X、N两种元素的气态氢化物的沸点相比,前者较低 |
| C.由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
| D.Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
X、Y、Z、W、M五种元素的原子序数依次增大。已知X、Y、Z、W是短周期元素中的四种非金属元素,X元素的原子形成的阴离子核外电子排布与氦原子相同,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍,M是地壳中含量最高的金属元素。下列说法中正确的是
| A.五种元素的原子半径从大到小的顺序是:M>W>Z>Y>X |
| B.化合物X2W2、YW2、ZW2等都含有极性共价键和非极性共价键 |
| C.用M单质作阳极,石墨电极作阴极电解NaHCO3溶液,电解一段时间后,在阴极区会出现白色沉淀 |
| D.X、Z两元素能形成原子个数比为3∶1和4∶2的化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com