
烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)3·Al2O3]溶液,并用于烟气脱硫研究。
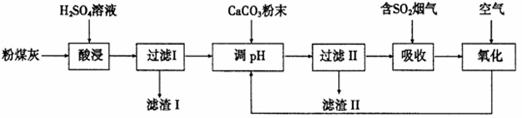
(1)酸浸时反应的化学方程式为 ;滤渣I的主要成分为 (填化学式)。
(2)滤渣Ⅱ的主要成分为 (填化学式);制备碱式硫酸铝[Al2(SO4)3·Al2O3]溶液的化学方程式为 。
(3)吸收烟气中SO2的化学方程式为Al2(SO4)3·Al2O3+3SO2 = Al(SO4)3·Al2(SO3)3。通入空气氧化,发生反应的化学方程式为 ;氧化后循环利用的溶液的pH将 (填“增大”、“减小”或“不变”)。
【答案】(1)Al2O3+3H2SO4=Al2(SO4)3+3H2O;SiO2;
(2)CaSO4·2H2O或CaSO4;2 Al2(SO4)3+3CaCO3+6H2O= Al2(SO4)3·Al2O3+3CaSO4·2H2O+CO2↑
或2Al2(SO4)3+3 CaSO4= Al2(SO4)3·Al2O3+3CaSO4+CO2↑;
(3)2 Al2(SO4)3·2Al2(SO3)3+3O2= 4Al2(SO4)3或2Al2(SO3)3+3O2= 2Al2(SO4)3;减小;
【解析】
试题分析:(1)酸浸时含Al2O3与硫酸发生复分解反应,反应的化学方程式为Al2O3+3H2SO4=Al2(SO4)3+3H2O;SiO2等不能与酸反应,所以滤渣I的主要成分是SiO2;(2)在滤液中含有过量的硫酸和硫酸铝,当向其中加入CaCO3时,会发生复分解反应:CaCO3+H2SO4= CaSO3+ CO2↑+ H2O;由于硫酸钙微溶于水,所以滤渣Ⅱ的主要成分为CaSO4或写为石膏CaSO4·2H2O;制备碱式硫酸铝[Al2(SO4)3·Al2O3]溶液的化学方程式为2Al2(SO4)3+3CaCO3+6H2O= Al2(SO4)3·Al2O3+3CaSO4·2H2O+CO2↑ 或2Al2(SO4)3+3 CaSO4= Al2(SO4)3·Al2O3+3CaSO4+CO2↑;(3)吸收烟气中SO2的化学方程式为Al2(SO4)3·Al2O3+3SO2 = Al(SO4)3·Al2(SO3)3。通入空气氧化,空气中的氧气能够把Al2(SO3)3氧化为Al(SO4)3·发生反应的化学方程式为2 Al2(SO4)3·2Al2(SO3)3+3O2= 4Al2(SO4)3或2Al2(SO3)3+3O2= 2Al2(SO4)3;氧化后循环利用的溶液由弱酸弱碱盐变为强酸弱碱盐,所以溶液的酸性增强,故溶液的pH将减小。
考点:考查物质的性质及转化的方程式表示、盐的水解的知识。


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
下列关于物质性质与应用的说法正确的是 ( )
A.碳具有还原性,高温条件下能将二氧化硅还原为硅
B.二氧化硫有漂白、杀菌性能,可在食品加工中大量使用
C.二氧化硅是半导体材料,可将太阳能直接转化为电能
D.二氧化锰具有较强的的氧化性,可作H2O2分解的氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生反应:H2NCOONH4(s)⇌2NH3(g)+CO2(g)在不同温度下,该反应平衡状态部分数据见表.下列说法正确的是( )
| 温度 | 平衡浓度/(mol L﹣1) | |
| c(NH3) | c(CO2) | |
| T1 | 0.1 | |
| T2 | 0.1 |
|
| A. | 若T2>T1,则该反应的△H<0 |
|
| B. | 向容器中充入N2,H2NCOONH4质量增加 |
|
| C. | NH3体积分数不变时,说明该反应达到平衡 |
|
| D. | T1、T2时,H2NCOONH4转化的△n(T2)=2△n(T1) |
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁均为中学化学中常见的单质或化合物,它们之间的转化关系如下图所示(部分产物已略去),下列各组物质中不能按图示关系转化的是
| 选项 | 物质转化关系 | 甲 | 乙 | 丙 | 丁 |
| A |
| NaOH | NaHCO3 | Na2CO3 | CO2 |
| B | AlCl3 | NaAlO2 | Al(OH)3 | NaOH | |
| C | Fe | Fe(NO3)3 | Fe(NO3)2 | HNO3 | |
| D | C | CO | CO2 | O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中不正确的是
| 甲 | 乙 | 丙 | 丁 | ||
| 密闭容器体积/L | 2 | 2 | 2 | 2 | |
| 起始物质的量 | n(SO2)/mol | 0.40 | 0.80 | 0.80 | 0.40 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
| SO2的平衡转化率% | 80 |
|
|
|
A.甲中反应的平衡常数小于乙 B.该温度下,该反应的平衡常数K为400
C.SO2的平衡转化率: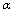 1<
1<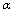 2 =
2 = 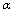 3 D.容器中SO3的物质的量浓度:丙=丁<甲
3 D.容器中SO3的物质的量浓度:丙=丁<甲
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各化学反应的离子方程式中,有错误的是( )
A.铝与氢氧化钠反应:2Al+2OH-+2H2O=2AlO2-+3 H2↑
B.氧化铝溶于氢氧化钠溶液:Al2O3+2OH-=2AlO2-+H2O
C.碘化亚铁溶液中滴入足量溴水:2Fe2++2I-+2Br2=I2+2Fe3++4Br-
D.碳酸氢镁溶液中加过量澄清石灰水
Mg2++2HCO3-+2Ca2++4OH-=2CaCO3↓+2H2O+Mg(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
下列制取、检验、提纯或保存物质的方法可行的是( )
①向某溶液中加入KSCN溶液,检验该溶液是否含有Fe3+
②用植物油、NaOH溶液制取肥皂 ③向FeCl3饱和溶液中滴加NaOH溶液制取Fe(OH)3胶体 ④用焰色反应检验K+时需透过蓝色钴玻璃观察 ⑤少量液溴用水液封后密封保存在棕色试剂瓶中 ⑥向混有乙酸的乙酸乙酯中加入NaOH溶液后再分液,提纯乙酸乙酯
A.①③⑤⑥ B.②④⑤⑥ C.①②④⑤ D.①③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
以下对粒子结构或性质的叙述正确的是
A.两种微粒,若核外电子排布完全相同,则化学性质一定相同
B.由单原子形成的离子,一定具有稀有气体元素原子核外电子排布
C.阴离子的核外电子排布一定与上一周期稀有气体原子核外排布相同
D.两原子,如果核外电子排布相同,则一定属于同一种元素
查看答案和解析>>
科目:高中化学 来源: 题型:
向Fe2O3、CuO、Fe、Cu的混和粉末中加入过量的稀硫酸,充分反应后,仍有红色粉末存在,则关于溶液中阳离子的判断正确的是 ( )
A.只有Fe2+和Cu2+ B.一定有Fe2+、Cu2+,可能有Fe3+
C.一定有Fe2+,可能有Cu2+ D.只有Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com