
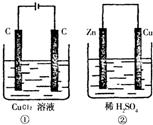
 如图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑气体的溶解和溶液体积的变化,则下列叙述中正确的是( )
如图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑气体的溶解和溶液体积的变化,则下列叙述中正确的是( )

科目:高中化学 来源: 题型:阅读理解
| 1 |
| 3 |
| 1 |
| 3 |

查看答案和解析>>
科目:高中化学 来源:四川省洪雅中学高三2009年二月份月考理综试题化学部分 题型:058
某校化学实验兴趣小组为了证明在实验室制备Cl2的过程中会有水蒸气和HCl挥发出来,甲同学设计了如图所示的实验装置,按要求回答问题:

(1)写出装置②中发生反应的化学方程式______________.
(2)请根据甲同学的意图,连接相应的装置应是(填接口字母代号):
b接________,________接________,________接a.
(3)U形接管中所盛放试剂的化学式为________.
装置③中CCl4的作用是________.
(4)乙同学认为甲同学的实验有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种.为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出在某两个装置之间再加装装置⑤,你认为装置⑤应加在________之间(填装置序号)瓶中可以放入________.
(5)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3的溶液换成其他溶液.你采取的措施是:________,则证明Cl2产生时有HCl挥发出来.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:2010-2011学年湖南省衡阳市祁东三中高三(上)第三次周考化学试卷(解析版) 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com