
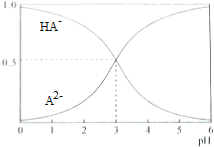
| A. | pH=5时,c(HA-)>c(A2-)>c(H+)>c(OH-) | |
| B. | 在Na2A溶液中存在c(Na+)=2c(A2-)+2c(HA-) | |
| C. | 等物质的量浓度的NaHA和Na2A混合溶液中,c(Na+)>c(A2-)>c(HA-) | |
| D. | 电离平衡HA-?A2-+H+的平衡常数Ka=10-3 |
分析 A.pH=5时,溶液呈酸性,溶液中c(HA-)>c(A2-),HA-的电离程度大于A2-水解程度,但其电离和水解程度都较小;
B.在任何电解质溶液中都存在物料守恒,根据物料守恒判断;
C.等物质的量浓度的NaHA和Na2A混合溶液呈酸性,说明HA-的电离程度大于A2-水解程度,结合物料守恒判断;
D.根据pH=3时计算其电离平衡常数.
解答 解:A.pH=5时,溶液呈酸性,溶液中c(HA-)>c(A2-),HA-的电离程度大于A2-水解程度,但其电离和水解程度都较小,所以离子浓度大小为c(HA-)>c(A2-)>c(H+)>c(OH-),故A正确;
B.在任何电解质溶液中都存在物料守恒,根据物料守恒得c(Na+)=2c(A2-)+2c(HA-)+2c(H2A),故B错误;
C.等物质的量浓度的NaHA和Na2A混合溶液呈酸性,说明HA-的电离程度大于A2-水解程度,所以c(A2-)>c(HA-),结合物料守恒得c(Na+)>c(A2-)>c(HA-),故C正确;
D.电离平衡常数只与温度有关,所以pH=3时电离平衡HA-?A2-+H+的平衡常数Ka=$\frac{c({H}^{+}).c({A}^{2-})}{c(H{A}^{-})}$=$\frac{1{0}^{-3}×0.5}{0.5}$=10-3,故D正确;
故选B.
点评 本题以酸碱混合溶液定性判断为载体考查离子浓度大小比较、电离平衡常数有关计算等知识点,明确溶液中溶质及其性质、电解质溶液酸碱性是解本题关键,注意守恒思想的灵活运用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 碳只存在金刚石和石墨两种同素异形体 | |
| B. | Mg、MgO中微粒的半径:r(O2-)>r(Mg2+)>r(Mg) | |
| C. | 在该反应条件下,Mg的还原性强于C的还原性 | |
| D. | 相同质量的镁在足量的CO2和O2中完全燃烧,固体质量增重相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该冶炼锌的反应属于置换反应 | |
| B. | 煤炭中起作用的主要成分是C | |
| C. | 冶炼Zn的反应方程式为:ZnCO3+2C$\frac{\underline{\;高温\;}}{\;}$Zn+3CO↑ | |
| D. | 倭铅是指金属锌和铅的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
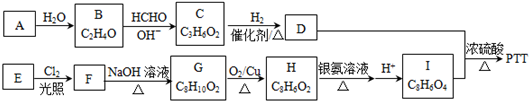
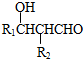
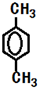 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
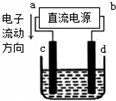
| A. | a为负极、b为正极 | B. | a为阳极、b为阴极 | ||
| C. | 电解过程中,钠离子浓度不变 | D. | 电解过程中,d电极附近变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com