
����˵����ȷ����
�ٽ����뺣���������γ�ͨ���뽺��������й�
�ڡ����͡���ʹ�õ����ᱵ���������
�۱��ɱ����Ǵ��������ǻ�����
���������ܽ����������¿ɹ۲쵽���������
��ij��ɫ��Һ�м���ϡ���ᣬ�����������ʹ����ʯ��ˮ����ǣ���ԭ��Һ��һ����CO32��
��������������Fe��OH��3�����KCl��Һ
A���٢ۢܢ� B���٢ۢܢ�
C���٢ۢܢݢ� D���٢ڢۢܢݢ�
 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ�������ĴΣ�12�£��¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���б�ʾ��Ӧ��ѧ��Ӧ�����ӷ���ʽ��ȷ����
A��Fe2O3����HI��Һ�У�Fe2O3 + 6H+ ��2Fe3++ 3H2O
B��̼���Ƶ�ˮ��������
CO32��+ 2H2O H2CO3 + 2OH��
H2CO3 + 2OH��
C����������Һ�еμӹ���Ũ��ˮ��Al3����4NH3��H2O===AlO ��4NH4����2H2O
��4NH4����2H2O
D���ù���������ữ�����ҽ���Һ����ȡ�⣺2I��+H2O2+2H+ =I2 +2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016������������һ��ѧ������ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��FECl3��Һ��ʴӡˢ��·���ϵ�ͭ��������Һ�м������ۡ��Լ������۳�ַ�Ӧ�����Һ������������
A��������ʣ�࣬����Һ��һ����FE3��
B�����й�����ڣ�����Һ��һ����FE2��
C������Һ����Cu2������һ��û�й�������
D������Һ����FE2������һ����Cu����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016�㽭����Чʵ��ѧ��һ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ͼ�٢ڢ�ԭ�ӽṹģ�������η���¬ɪ���������١���ķ���Ĺ۵����
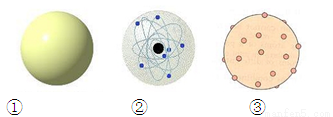
A���٢ڢ� B���ۢ٢�
C���ۢڢ� D���ڢ٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016�㽭����Чʵ��ѧ�߶������п��Ի�ѧ�Ծ����������棩 ���ͣ�ѡ����
����������˵��ij��ѧƽ��һ�������ƶ�����
A��������и���ֵ�Ũ�ȸı�
B�������ϵ�������ܶȷ����仯
C�������淴Ӧ���ʸı�
D����Ӧ���ת���ʸı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�챱���г�����������ѧ������ͳ����ѧ�Ծ��������棩 ���ͣ�ѡ����
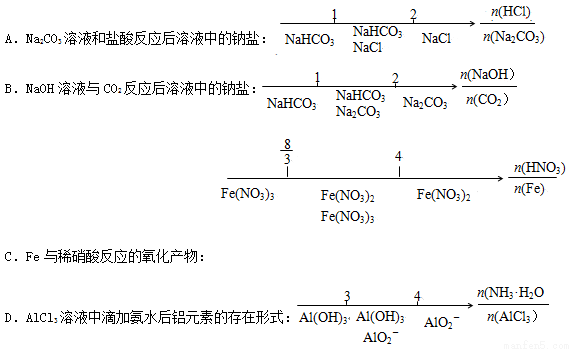
�о���Ӧ��Ļ�ѧ�����������֮��Ĺ�ϵʱ��ʹ����������ķ�����ʾ ���������⡣���б�����ȷ����
���������⡣���б�����ȷ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�츣��ʡ��ϼ�����С�����ʮ�и���������������ѧ�Ծ��������棩 ���ͣ�ѡ����
����ȷ��ʾ���з�Ӧ�����ӷ���ʽ
A��Ũ��������м��Ӧ��2Fe + 6H+ = 2Fe3+ + 3H2��
B������CuSO4��Һ��Ӧ��2Na + Cu2+ = Cu��+ 2Na+
C��NaHCO3��Һ��ϡH2SO4��Ӧ:CO32�� + 2H+ = H2O + CO2��
D����������������������Һ�� 2Al+2OH-+2H2O=2[Al(OH)4]-+ 3H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��ɽ��ʡ�ൺ�и�����ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ������
��1��������FeS2�������������ұ����������Ҫԭ�ϣ�����һ����ӦΪ3FeS2+8O2=6SO2+Fe3O4����������Ϊ ������3mol FeS2�μӷ�Ӧ��ת�Ƶ�����Ϊ ��
��2�����������ƣ�������Ҳ��������ˮ������ԭ��Ϊ �������ӷ��̱�ʾ��
��3�����ȵ�ϡ������Һ���ܽ�һ������FeSO4���ټ���������KNO3��Һ����ʹ���е�Fe2+ȫ��ת����Fe3+�����������ݳ�����д����Ӧ�����ӷ���ʽ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�챱���к�����������ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ������
���Ȼ���(PCl5)���л��ϳ�����Ҫ���Ȼ��������������Ȼ���(PCl3)�Ȼ��õ���
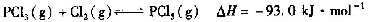 ��ij�¶��£����ݻ��㶨Ϊ2.0L���ܱ������г���2.0molPCl3��1.0molCl2��һ��ʱ���Ӧ��ƽ��״̬��ʵ���������±���ʾ��
��ij�¶��£����ݻ��㶨Ϊ2.0L���ܱ������г���2.0molPCl3��1.0molCl2��һ��ʱ���Ӧ��ƽ��״̬��ʵ���������±���ʾ��

��1�� 0~150s�ڵ�ƽ����Ӧ����
��2�� ���¶��£��˷�Ӧ�Ļ�ѧƽ�ⳣ������ֵΪ___________(���÷�����ʾ)��
��3�� ��Ӧ��250s ʱ���÷�Ӧ�ų�������Ϊ______________kJ��
��4�� ���й���������Ӧ��˵���У���ȷ����__________(����ĸ���)��
a�� �����Ƿ��ƽ��״̬�����������ܶ�ʼ�ղ���
b�� 300s ʱ�������¶ȣ������淴Ӧ����ͬʱ����
c�� 350s ʱ������ܱ������г��뵪����ƽ��������Ӧ�����ƶ�
d�� ��ͬ�����£�����ʼ����ܱ������г���1.0molPCl3��0.2molCl2���ﵽ��ѧƽ��״̬ʱ��n(PCl5 ) < 0.20mol
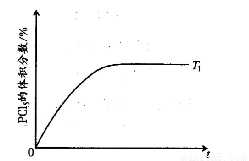
��5�� �¶�T 1ʱ�����������PCl5 �����������ʱ��t �仯��ʾ��ͼ���¡�����������ͬ��������ͼ�л����¶�ΪT 2(T 2> T 1)ʱ��PCl5�����������ʱ��仯�����ߡ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com