
下图是部分短周期元素原子序数与最外层电子数之问的关系图,下列说法中正确的是

A、元素对应的离子半径:Z>M>R>W
B、简单氢化物的沸点:W>R>Y>X
C、M、N、R、W的简单离子均能促进水的电离
D、Z、X、R、W的最高价氧化物对应的水化物均能与N的单质反应
科目:高中化学 来源:2014-2015湖北省襄阳市高二3月月考化学试卷(解析版) 题型:选择题
25℃时,用浓度为0.1000 mol/L的NaOH溶液滴定20.00 mL浓度均为0.1000 mol/L的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法不正确的是

A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ>HY>HX
B.根据滴定曲线,可得Ka(HY)≈10—5
C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(Y—)>c(X—)>c(OH—)>c(H+)
D.HY与HZ混合,达到平衡时: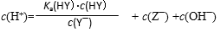
查看答案和解析>>
科目:高中化学 来源:2014-2015学年新疆乌鲁木齐地区高三第二次诊断性测试化学试卷(解析版) 题型:选择题
下列关于有机物的描述正确的是
A.葡萄糖和果糖互为同分异构体,淀粉和纤维素也互为同分异构体
B.淀粉、油脂和蛋白质都能发生水解反应
C.多糖、蛋白质、脂肪和聚丙烯都属于高分子化合物
D.汽油、柴油和植物油都是碳氢化合物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省高三下学期第一次模考化学试卷(解析版) 题型:选择题
下列对图象描述正确的是

A.图①表示体积和pH值均相同的稀硫酸和醋酸,与足量的镁反应生成H2量的关系
B.图②表示向NaOH溶液中滴加稀盐酸,溶液导电性变化的关系
C.图③表示2SO2(g)+O2(g) 2SO3(g)反应过程中,SO2和O2反应速率大小关系
2SO3(g)反应过程中,SO2和O2反应速率大小关系
D.图④表示向氨水中滴加稀硫酸时,溶液的pH大小变化关系
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市延庆县高三3月模拟理综化学试卷(解析版) 题型:填空题
(14分)SO2 、CO 、NOx 是对环境影响较大的气体,对它们的合理控制和治理是优化我们生存环境的有效途径。请回答下列问题:
(1)已知25℃、101kPa时:
2SO2(g) + O2(g)  2SO3(g) △H1 = - 197 kJmol-1
2SO3(g) △H1 = - 197 kJmol-1
H2O(g) = H2O(l) △H2 = - 44 kJmol-1
2SO2(g) + O2(g) + 2H2O(g) = 2H2SO4(l) △H3 = - 545 kJmol-1
则SO3(g)与H2O(l)反应的热化学方程式是 。
(2)若反应2H2(g)+ O2 (g)=2H2O(g ),△H=-241.8kJmol-1,根据下表数据则x=______kJmol-1。
化学键 | H-H | O═O | O-H |
断开1mol化学键所需的能量/kJ | 436 | x | 463 |
(3)甲醇汽油也是一种新能源清洁燃料。工业上可用CO和H2制取甲醇,热化学方程式为:CO(g)+2H2(g) CH3OH(g) △H=-90 kJmol-1
CH3OH(g) △H=-90 kJmol-1
①该温度下,在两个容积均为1 L的密闭容器中,分别发生该反应:
容器 | 甲 | 乙 |
反应物投入量 | 1 mol CO (g)和2 mol H2(g) | 1 mol CH3OH(g) |
平衡时c(CH3OH) | c1 | c2 |
平衡时能量变化 | 放出54kJ | 吸收a kJ |
则c1_________ c2(填“>”或“<”或“=”),a=____________。
②若密闭容器容积与①相同,Ⅰ、Ⅱ曲线分别表示投料比不同时的反应过程。若Ⅱ反应的n(CO)起始 =10 mol、投料比为0.5,则:
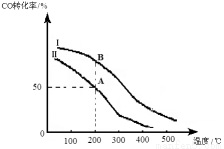
A点的平衡常数KA= ,
B点的平衡常数KB KA。 (填“>”或“<”或“=”)
③为提高CO转化率可采取的措施是 (至少答出两条)。
(4)电解NO制备NH4NO3,其工作原理如图所示,
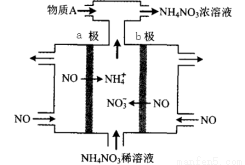
则a电极名称为_______,
b电极反应式为_________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市延庆县高三3月模拟理综化学试卷(解析版) 题型:选择题
下列单质或化合物性质的描述正确的是
A.NaHSO4水溶液显中性
B.SiO2与酸、碱均不反应
C.NO2溶于水时发生氧化还原反应
D.Fe在足量Cl2中燃烧生成FeCl2和FeCl3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市房山区高三一模理综化学试卷(解析版) 题型:选择题
在一定温度下,将6 mol C02和8 mol H2充入2L恒容密闭容器中,发生如下反应:
CO2(g) + 3H2(g)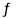 CH30H(g) + H20(g) △H < O
CH30H(g) + H20(g) △H < O
分别在t时测得在该容器内n(H2)的数值如下:
t/min | 1 | 4 | 8 | 11 |
n(H2)/mol | 6 | 2.6 | 2 | 2 |
则下列说法正确的是
A.该温度下,平衡常数K = 0.5
B.反应进行4min时,V正(C02) = 0.45 mol/(L·min)
C.反应进行到9min时,H2的转化率比8min时高
D.反应进行11min后,若增大容器内压强,CO2的转化率一定增大
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省韶关市高三调研考试理综化学试卷(解析版) 题型:选择题
设NA为阿佛加德罗常数的数值,下列说法正确的是(相对原子质量:Na=23 Fe=56 H=1 C=12 O=16 )
A.1 mol Na2O2固体中含离子总数为3NA
B.0.10 mol Fe粉与足量水蒸气反应生成的H2分子数为0.10NA
C.40g NaOH溶于1L水中,所得NaOH 溶液的物质的量浓度为1mol/L
D.标准状况下,11.2 L苯中含有分子的数目为0.5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com