


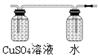
 (图及试剂均正确得2分,B中也可装入NaOH溶液)
(图及试剂均正确得2分,B中也可装入NaOH溶液) CaSiO3(2分)
CaSiO3(2分)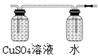 。
。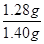 ×100%=91.43%。
×100%=91.43%。 CaSiO3。
CaSiO3。

 一课一练课时达标系列答案
一课一练课时达标系列答案 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.①④⑤⑥⑦⑧ | B.①②④⑤ | C.①④⑤⑥ | D.全部 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
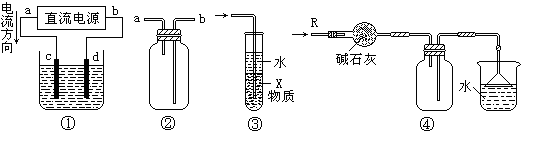
| A.装置①中,d为阳极、c为阴极 |
| B.装置②可用于收集H2、NH3、CO2、Cl2、NO2等气体 |
| C.装置③中X若为四氯化碳,可用于吸收氨气,并防止倒吸 |
| D.装置④可用于干燥、收集氨气,并吸收多余的氨气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 编号 | 实验 | 操作 |
| A | 钠与水反应 | 用镊子从煤油中取出金属钠,切下绿豆大小的钠, 小心放入装满水的烧杯中。 |
| B | 制备并检验氢气的可燃性 | 锌粒与稀硫酸反应产生气体,立即点燃。 |
| C | 用浓硫酸制稀硫酸 | 把水沿器壁倒入装有浓硫酸的烧杯中,并用玻璃 棒不断搅拌。 |
| D | 一氧化碳还原氧化铜 | 用石灰水检验气体产物,实验结束时先从水槽中[ 取出导管,再熄灭酒精灯。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③④ | B.①②⑥ | C.①③⑤ | D.③④⑦ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.滴定管装液前只需水洗、润洗 | B.在通风橱中取用溴 |
| C.用pH试纸测得某氯水的pH为2 | D.用100 mL量筒取70.5 mL蒸馏水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.泥沙和水的混合物可以直接用分液漏斗分离 |
| B.用水可以区分苯和四氯化碳 |
| C.配制稀硫酸时,可在量筒中加入一定体积的水,再慢慢加入浓硫酸 |
| D.用托盘天平称量11.72g氯化钾固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com