
| 元素编号 | a | b | c | d | e | f | g | h | i | j |
| 原子半径/pm | 111 | 77 | 70 | 104 | 143 | 99 | 117 | 186 | 160 | 64 |
| 最高化合价或 最低化合价 | +2 | -4 | -3 | +6 | +3 | -1 | +4 | +1 | +2 | -1 |
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 1 | ||||||||
| 2 | ||||||||
| 3 | ||||||||
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 1 | ||||||||
| 2 | a | b | c | j | ||||
| 3 | h | i | e | g | d | f | ||
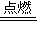 2MgO+C.
2MgO+C.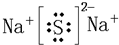
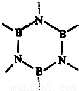 .
.

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
现有下列短周期元素性质的数据:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | a | b | c | d | e | f | g | h | i | j |
| 原子半径/pm | 111 | 77 | 70 | 104 | 143 | 99 | 117 | 186 | 160 | 64 |
| 最高化合价或 最低化合价 |
+2 | -4 | -3 | +6 | +3 | -1 | +4 | +1 | +2 | -1 |
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ||||||||
| 2 | a a |
b b |
c c |
j j |
||||
| 3 | h h |
i i |
e e |
g g |
d d |
f f |
||
| ||
| ||
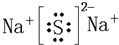
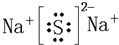


查看答案和解析>>
科目:高中化学 来源: 题型:

| 元素编号 元素性质 |
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 |
| 最高增化合价 | +2 | +1 | +5 | +7 | +1 | +5 | |
| 最低化合价 | -2 | -3 | -1 | -3 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号元素性质 | ① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 元素性质 |
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径 (10-10m) |
0.74 | 1.02 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最低化合价 | +6 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -2 | -3 | -1 | -3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com