


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
| A、A元素在周期表中的位置是第六周期第ⅠA族 |
| B、单质A性质稳定 |
| C、A元素的最高价氧化物的水化物是一种强碱 |
| D、A有多种氧化物,但均不与水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③⑤ | B、②③⑤ |
| C、②③ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO4=2H++S6++4O2- |
| B、AlCl3=Al3++Cl3- |
| C、Ba(OH)2=Ba2++2OH- |
| D、Na2CO3=Na2++CO32- |
查看答案和解析>>
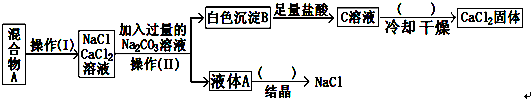
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、天然物质都是绿色无毒的物质 |
| B、只饮用纯净水有益人体健康 |
| C、微量元素只能通过保健品摄入 |
| D、植物油和动物脂肪要搭配食用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com