
| A. | 钠在空气中燃烧只生成白色的氧化钠固体 | |
| B. | 燃着的镁条伸入盛满二氧化碳的集气瓶中不能继续燃烧 | |
| C. | 铜能与氯化铁溶液反应,该反应可以用于印刷电路板的制作 | |
| D. | 铁能与硫酸发生反应,故不能用铁制容器贮存浓硫酸 |
分析 A.钠在空气中燃烧生成过氧化钠;
B.镁与二氧化碳反应生成氧化镁和碳;
C.三价铁离子能够氧化铜生成铜离子和二价铁离子;
D.浓硫酸具有强的氧化性,常温下能够使铁钝化.
解答 解:A.钠在空气中燃烧只生成淡黄色的过氧化钠固体,故A错误;
B.燃着的镁条伸入盛满二氧化碳的集气瓶中能继续燃烧生成氧化镁和碳,故B错误;
C.三价铁离子能够氧化铜生成铜离子和二价铁离子,所以可以用于印刷电路板的制作,故C正确;
D.浓硫酸具有强的氧化性,常温下能够使铁钝化,形成致密氧化膜,阻止反应进行,所以能用铁制容器贮存浓硫酸,故D错误;
故选:C.
点评 本题考查了元素化合物知识,熟悉钠、镁、浓硫酸、三价铁离子的性质是解题关键,注意浓硫酸的强氧化性,注意钝化属于化学变化,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 2L0.5mol/L亚硫酸钠溶液中含有的H+离子数为2NA | |
| B. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
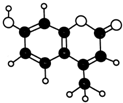
| A. | 分子式为C11H9O3 | B. | 不能使溴水褪色 | ||
| C. | 属于芳香族化合物 | D. | 不能与Na0H溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯能使酸性高锰酸钾溶液褪色,是因为乙烯分子中含有碳碳双键 | |
| B. | 苯可以使溴水褪色,是发生了加成反应 | |
| C. | 乙醛在一定条件下与氧气反应生成乙酸,乙醛发生了氧化反应 | |
| D. | 氨基酸分子中均含有羧基(-COOH)和氨基(-NH2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
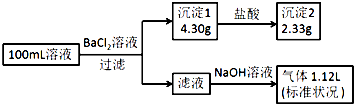 某100mL溶液可能含有Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )
某100mL溶液可能含有Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )| A. | 原溶液一定存在CO32-和SO42-,一定不存在Fe3+ | |
| B. | 原溶液一定存在Cl-,可能存在Na+ | |
| C. | 原溶液中c(Cl-)≥0.1mol•L-1 | |
| D. | 若原溶液中不存在Na+,则c(Cl-)<0.1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
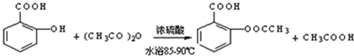
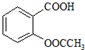 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如图1:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如图1: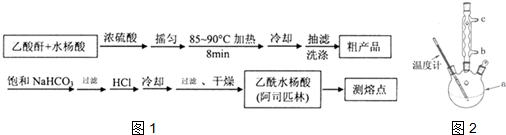
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸 | 102 | 139.4(沸点) | 反应 |
| 乙酸水杨酸 | 180 | 135(熔点) | 微溶 |
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com