
2013年6月11日我国成功发射了“神州十号”。这标志着中国人的太空时代又前进了一大步。发射“神十”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。已知:
N2(g)+2O2(g)=2NO2(g);△H=+67.7 kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534 kJ/mol
下列关于肼和NO2反应的热化学方程式中,正确的是
| A.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l);△H=-1135.7 kJ/mol |
| B.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1000.3 kJ/mol |
| C.N2H4(g)+NO2(g)=3/2N2(g)+2H2O(l);△H=-1135.7 kJ/mol |
| D.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1135.7 kJ/mol |
D
解析试题分析:已知:①N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ/mol,②N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ/mol,根据盖斯定律,②×2-①得2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);故△H=2×(-534kJ/)-67.7kJ/mol="-1135.7" kJ/mol,肼和NO2生成N2和水蒸气的热化学方程式为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) △H="-1135.7" kJ/mol,A、水的状态应为气态,不是液态,故A错误;B、反应热为△H="-1135.7" kJ/mol,不是△H="-1000.3" kJ/mol,故B错误;C、1molN2H4(g)反应,水的状态应为气态,不是液态,故C错误;D、由上述分析可知,肼和NO2生成N2和水蒸气的热化学方程式为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) △H="-1135.7" kJ/mol,故D正确;故选D。
考点:考查热化学方程式的书写


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:单选题
据人民网报道,有一集团拟在太空建立巨大的激光装置,把太阳光变成激光用于分解海水制氢气,其反应式可表示为:2H2O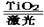 2H2↑+O2↑。有下列几种说法:①水的分解反应是放热反应;②氢气是一级能源;③使用氢气作燃料有助于控制温室效应;④该过程将光能转化为化学能,以上叙述中正确的是
2H2↑+O2↑。有下列几种说法:①水的分解反应是放热反应;②氢气是一级能源;③使用氢气作燃料有助于控制温室效应;④该过程将光能转化为化学能,以上叙述中正确的是
| A.①② | B.②③ | C.③④ | D.①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
肼(N2H4)是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式中正确的是
A.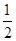 N2H4(g)+ N2H4(g)+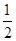 O2(g)=== O2(g)===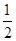 N2(g)+H2O(g) ΔH=+267 kJ·mol-1 N2(g)+H2O(g) ΔH=+267 kJ·mol-1 |
| B.N2H4(g)+O2(g)===N2(g)+2H2O(l) ΔH=-133.5 kJ·mol-1 |
| C.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1 |
| D.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=+534 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知某反应的能量变化如图所示,下列说法正确的是
| A.该反应可用于表示烧碱与硫酸反应 |
| B.该反应只有在加热条件下才能进行 |
| C.反应物的总能量高于生成物的总能量 |
| D.该反应可用于表示碳酸钙受热分解的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
根据热化学方程式:S(g)+O2(g) SO2(g) △H=-QkJ·mol-1(Q>0),下列分析正确的是( )
SO2(g) △H=-QkJ·mol-1(Q>0),下列分析正确的是( )
| A.1 mol S(g)与1 mol O2(g)反应生成1 mol SO2(g)放出QkJ的热量 |
| B.1个S(g)与1个O2(g)完全反应要放出Q kJ的热量 |
C.S(s)+O2(g) SO2(g) △H<-Q kJ·mol-1 SO2(g) △H<-Q kJ·mol-1 |
| D.1 mol S(g)与1 mol O2(g)的总能量比1 mol SO2(g)的总能量低QkJ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
根据四种变化:①Fe(s)→Fe(g);②2H2(g)+ O2(g)=2H2O(g) △H="-482" kJ·mol-1;
③C(s)+CO2(g)=2CO(g);④NaOH(s)=Na+(aq)+OH-(aq)。 请回答下列问题
⑴上述变化中,需要吸收热量的是 (请填变化的代码①②③④,下同)。
⑵上述变化中,体系的混乱度增大的是 。
⑶已知下列两种键能,H-H:436 kJ·mol-1、O-H:463 kJ·mol-1,请计算断裂1 molO2(g)中的共价键需要吸收 kJ的能量。
⑷下面几种说法中。正确的是 [
| A.化合反应都大多是放热反应 |
| B.凡是需要加热的反应,都是吸热反应 |
| C.体系的混乱度增大的反应都是吸热反应 |
| D.中和反应是放热反应,其化学能可以转化成电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关热化学方程式的评价合理的是( )
| | 实验事实 | 热化学方程式 | 评价 |
| A | 已知H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ·mol-1,将稀硫酸与稀氢氧化钡溶液混合 | H2SO4(aq)+Ba(OH)2(aq) =BaSO4(s)+ 2H2O(l) △H=-114.6 kJ·mol-1 | 正确 |
| B | 醋酸与稀氢氧化钠溶液混合 | CH3COOH(aq)+NaOH(aq) =CH3COONa(aq)+H2O(l) △H=-57.3kJ·mol-1 | 不正确;因为醋酸状态为“aq”,而不是“l”。 |
| C | 160 g SO3气体与适量水恰好完全反应生成H2SO4,放出热量260.6 kJ | SO3(g)+H2O(l)=H2SO4(aq) △H=-130.3 kJ·mol-1 | 不正确;因为反应热为△H=-260.6kJ·mol-1 |
| D | 已知25℃、101 kPa下,120g石墨完全燃烧放出热量3935.1 kJ | C(s)+O2(g)=CO2(g) △H=-393.51 kJ·mol-1 | 不正确;同素异形体要注名称:C(石墨) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:P4(g)+6Cl2(g)===4PCl3(g) ΔH=a kJ·mol-1,
P4(g)+10Cl2(g)===4PCl5(g) ΔH=b kJ·mol-1,
又知形成或拆开1 mol化学键放出或吸收的能量称为该化学键的键能。P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ·mol-1,PCl3中P-Cl键的键能为1.2c kJ·mol-1。下列叙述正确的是
| A.P-P键的键能大于P-Cl键的键能 |
| B.可求Cl2(g)+PCl3(g)===PCl5(s)的反应热ΔH |
| C.Cl-Cl键的键能为(b-a+5.6c)/4 kJ·mol-1 |
| D.P-P键的键能为(5a-3b+12c)/8 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于反应热和热化学反应的描述中正确的是
| A.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3) kJ·mol-1 |
| B.CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=+2×283.0 kJ·mol-1 |
C.氢气的燃烧热为285.5 kJ·mol-1,则电解水的热化学方程式为 |
| D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com