
| A. | 某品牌化妆品声称“我们拒绝化学,本品不含任何化学物质” | |
| B. | 用漂粉精和洁厕灵的混合液清洗马桶效果更佳 | |
| C. | 最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物 | |
| D. | 新核素的发现意味着新元素的合成 |
分析 A.任何物质都是由化学物质构成的;
B.洁厕剂主要成分为盐酸,与漂白粉中次氯酸钙反应生成氯化钙和氯气;
C.将反应物的原子全部转化为期望的最终产物,可以减少污染,使原料的利用率提高;
D.许多元素含有几种的同位素,因此新核素的发现不能代表新元素的合成.
解答 解:A.任何物质都是由化学物质构成的,不含化学物质的物质是不存在的,故A错误;
B.洁厕剂主要成分为盐酸,与次氯酸钙反应生成氯化钙和氯气,反应的离子方程式为ClO-+Cl-+2H+=Cl2↑+H2O,生成一种有毒气体氯气污染环境,故B错误;
C.按照绿色化学原则,最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物,这时原子利用率为100%,原子利用率=期望产物的总质量/生成物的总质量,故C正确;
D.许许多元素含有几种的同位素,因此新核素的发现不能代表新元素的合成,故D错误;
故选C.
点评 本题考查较为综合,涉及元素和核素的关系、元素及化合物的性质、绿色化学的思想等知识,题目难度不大,应注意的是绿色化学的思想是从源头上减少和消除工业生产对环境的污染.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:选择题
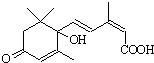 用S-诱抗素制剂,可以保证鲜花盛开.S-诱抗素的结构如图,下列关于该物质的说法正确的是( )
用S-诱抗素制剂,可以保证鲜花盛开.S-诱抗素的结构如图,下列关于该物质的说法正确的是( )| A. | 其分子中含有3种官能团 | |
| B. | 能发生氧化反应,又能发生取代反应 | |
| C. | 可以与FeCl3溶液发生显色反应 | |
| D. | 1 mol该物质与NaOH溶液反应,最多消耗2 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
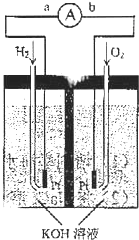 氢氧燃料电池是符合绿色化学理念的新型发电装置.下图为电池示意图,该电池电极表面镀一层细小的铂粉,附气体的能力强,性质稳定,请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.下图为电池示意图,该电池电极表面镀一层细小的铂粉,附气体的能力强,性质稳定,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
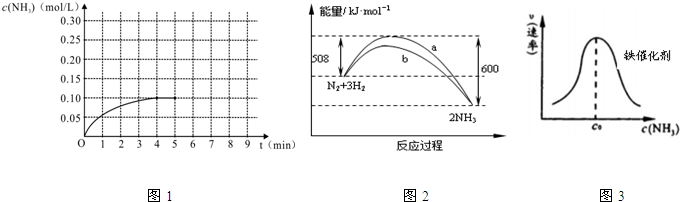
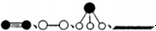 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示: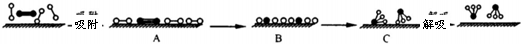
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
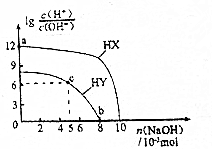
| A. | HX的酸性弱于HY | |
| B. | a点由水电离出的c(H+)=10-12mol•L-1 | |
| C. | c点溶液中:c(Y-)>c(HY) | |
| D. | b点时酸碱恰好完全中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X2为0.1mol/L | B. | X2为0.2mol/L | C. | Z2为0.3mol/L | D. | Z2为0.8mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com