
【题目】如图所示是工业生产硝酸铵的流程. 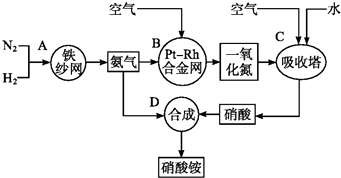
(1)写出N2和H2通过红热的铁纱网生成氨气的反应方程式: .
(2)B装置中Pt﹣Rh合金网的作用是 , 写出B中有关反应方程式: .
(3)写出D中反应方程式: .
(4)A,B,C,D四个容器中的反应,属于氧化还原反应的是(填字母).
【答案】
(1)N2+3H2 ![]() 2NH3
2NH3
(2)催化剂;4NH3+5O2 ![]() 4NO+6H2O
4NO+6H2O
(3)NH3+HNO3=NH4NO3
(4)ABC
【解析】解:(1)N2和H2在红热铁砂网的催化作用下合成氨气,化学方程式为:N2+3H2 ![]() 2NH3 , 所以答案是:N2+3H2
2NH3 , 所以答案是:N2+3H2 ![]() 2NH3;(2)B装置中在的催化作用下,氨气和氧气发生催化氧化反应,B装置中在Pt﹣Rh合金网的催化作用下,氨气和氧气发生催化氧化反应生成NO和H2O,化学方程式为:4NH3+5O2
2NH3;(2)B装置中在的催化作用下,氨气和氧气发生催化氧化反应,B装置中在Pt﹣Rh合金网的催化作用下,氨气和氧气发生催化氧化反应生成NO和H2O,化学方程式为:4NH3+5O2 ![]() 4NO+6H2O,所以答案是:催化剂;4NH3+5O2
4NO+6H2O,所以答案是:催化剂;4NH3+5O2 ![]() 4NO+6H2O;(3)在D中,NH3和HNO3反应生成NH4NO3 , 故化学方程式为:NH3+HNO3=NH4NO3所以答案是:NH3+HNO3=NH4NO3;(4)题中涉及的化学反应有:①N2+3H2
4NO+6H2O;(3)在D中,NH3和HNO3反应生成NH4NO3 , 故化学方程式为:NH3+HNO3=NH4NO3所以答案是:NH3+HNO3=NH4NO3;(4)题中涉及的化学反应有:①N2+3H2 ![]() 2NH3②4NH3+5O2
2NH3②4NH3+5O2 ![]() 4NO+6H2O③2NO+O2═2NO2④3NO2+H2O═2HNO3+NO⑤4NO2+O2+H2O═4HNO3⑥NH3+HNO3═NH4NO3 , 其中①②③④⑤属于氧化还原反应,即ABC属于氧化还原反应,所以答案是:ABC.
4NO+6H2O③2NO+O2═2NO2④3NO2+H2O═2HNO3+NO⑤4NO2+O2+H2O═4HNO3⑥NH3+HNO3═NH4NO3 , 其中①②③④⑤属于氧化还原反应,即ABC属于氧化还原反应,所以答案是:ABC.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质性质的应用正确的是( )
A. 液氨汽化时要吸收大量的热,可用作制冷剂
B. 二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸
C. 生石灰能与水反应,可用来干燥氯气
D. 氯化铝是一种电解质,可用于电解法制铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,反应X2(g)+Y2(g)2XY(g);△H<0,达到甲平衡.在仅改变某一条件后,达到乙平衡,图中对此过程的分析正确的是

A. 图I是加入适当催化剂的变化情况
B. 图Ⅱ是扩大容器体积的变化情况
C. 图Ⅲ是增大压强的变化情况
D. 图Ⅲ是升高温度的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
实验编号 | HA物质的量浓度 (mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | c | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸_________________________________________________。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2______(选填“是”或“否”)。混合液中离子浓度c(A-)与 c(Na+)的大小关系是____________________。
(3)丙组实验结果分析,HA是________酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是________________________________。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=_____________mol·L-1。写出该混合溶液中的下列算式的精确结果 (数据不能做近似计算,不用化简)。c(Na+)-c(A-)=____________mol·L-1 c(OH-)-c(HA)=____________mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.青铜是我国使用最早的合金,也是目前使用最广泛的合金
B.不管哪种铜合金都含有铜元素,所以它们的性质也和金属铜一样
C.我们日常生活中用到的铜合金制品主要是黄铜制的
D.各种铜合金都有良好的导电、导热性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中主要含有Na+、K+、Mg2+、Ca2+、Cl-、Br-、SO42-、HCO3-、CO32-等离子,火力发电时排放的烟气可用海水脱硫,其工艺流程如下图所示,下列说法错误的是

A.海水pH约为8的原因主要是天然海水含CO32-、HCO3-
B.吸收塔中发生的反应有SO2+H2O![]() H2SO3
H2SO3
C.氧化主要是氧气将HSO3-、SO32-、H2SO3氧化为SO42-
D.经稀释“排放”出的废水中,SO42-浓度与海水相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分是Al2O3、Fe2O3和SiO2等.从铝土矿中提炼Al2O3的流程如下: 
回答下列问题:
(1)写出反应1的化学方程式;
(2)滤液Ⅰ中加入CaO生成的沉淀是;
(3)工业生产中通入的气体A应过量,理由是;则反应2生成B的离子方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com