
����Ŀ�������������壨FeSO47H2O����ҽҩ������Ѫ����ij�����о�С��ⶨ�ò�Ѫ������Ԫ�صĺ�����ʵ�鲽�����£� 
��ش��������⣺
��1��֤���������Һ�к���Fe2+�ķ������ȵμ�KSCN��Һ���ٵμ� �� �ù��̵�����Ϊ�� ��
��2������ڼ������H2O2��Ŀ�ģ� ��
��3��������з�Ӧ�����ӷ���ʽ�� ��
��4����ʵ������ģ���ÿƬ��Ѫ������Ԫ�ص�����g��
��5����С����Щͬѧ��Ϊ��KMnO4��Һ�ζ�Ҳ�ܽ�����Ԫ�غ����IJⶨ��
��5Fe2++MnO4��+8H+=5Fe3++Mn2++4H2O��
��ʵ��ǰ������Ҫ��ȷ����һ�����ʵ���Ũ�ȵ�KMnO4��Һ250mL������ʱ��Ҫ����������ƽ���������ձ�����ͷ�ι��⣬���� ��
������ʵ���е�KMnO4��Һ��Ҫ�ữ�������ữ������ ��
a��ϡ���� b��ϡ���� c��ϡ���� d��Ũ����
�۵ζ����յ�ʱ����ɫΪɫ�����ζ����յ�ʱ���ӵζ��̶ܿ��ߣ��Բ���ֵ�к�Ӱ�죿�� �ƫ�ߡ�ƫ�ͻ���Ӱ�족����
���𰸡�
��1����ˮ����˫��ˮ��ϡ���ᣩ����Һ��ʼ����ɫ�����ΪѪ��ɫ
��2����Fe2+ȫ������ΪFe3+
��3��Fe3++3NH3?H2O�TFe��OH��3��+3NH4+
��4��0.07a
��5��250mL����ƿ��b���ϻ��Ϻ죻ƫ��
���������⣺��1��Fe3+��KSCN��Һ�Ժ�ɫ�����������ڼ���Fe3+���ڣ����Լ�����������Fe2+����ΪFe3+����Fe2+ �� �����ȵμ�KSCN��Һ����Һ����ɫ��������ˮ����˫��ˮ��ϡ���ᣩ������2Fe2++Cl2�T2Fe3++2Cl�� �� ��Һ��ΪѪ��ɫ������Fe3++3SCN��Fe��SCN��3 �� ˵������Fe2+ ��
���Դ��ǣ���ˮ����˫��ˮ��ϡ���ᣩ����Һ��ʼ����ɫ�����ΪѪ��ɫ����2��˫��ˮ���������ԣ������������ܽ�Fe2+ȫ������ΪFe3+ �� 2H++H2O2+2Fe2+=2Fe3++2H2O�����Դ��ǣ���Fe2+ȫ������ΪFe3+����3��������ǽ�Fe3+ת��Ϊ�����������������Լ��백ˮ����Ӧ���ӷ���ʽΪFe3++3NH3H2O�TFe��OH��3��+3NH4+ ��
���Դ��ǣ�Fe3++3NH3H2O�TFe��OH��3��+3NH4+����4��ag����������Ԫ�ص�������Ϊ10Ƭ��Ѫ������������������ÿƬ��Ѫ������Ԫ�ص����� ![]() =0.07ag�����Դ��ǣ�0.07a����5���پ�ȷ����һ�����ʵ���Ũ�ȵ�KMnO4��Һ250mL������ʱ��Ҫ����������ƽ��ҩ�ס��������ձ�����ͷ�ιܡ�250mL����ƿ�����Դ��ǣ�250mL����ƿ��
=0.07ag�����Դ��ǣ�0.07a����5���پ�ȷ����һ�����ʵ���Ũ�ȵ�KMnO4��Һ250mL������ʱ��Ҫ����������ƽ��ҩ�ס��������ձ�����ͷ�ιܡ�250mL����ƿ�����Դ��ǣ�250mL����ƿ��
�ڸ��������ǿ�����ԣ��ܽ�����������������������ԣ�������������������ֻ����ϡ�����ữ�����Դ��ǣ�b��
���ø��������Һ�ζ���������ʱ���ζ����յ�ʱ��Һ�������ɫ���Ϻ�ɫ�����ζ����յ�ʱ���ӵζ��̶ܿ��ߣ�������ĸ��������Һ�����ƫС�����Ի�ʹ����ֵƫ�ͣ�
���Դ��ǣ��ϻ��Ϻ죻ƫ�ͣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йؽ�����˵���У�����ȷ���ǣ� ��
A. ��ͭ������ֶ��ǺϽ� B. ͭ�ڿ����л�����ͭ��
C. �����Ͻ���۵����������ijɷֽ������۵� D. ���ǻ��ý��������ڿ�������ʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��װ�ý�����Ӧʵ�飬�ܴﵽʵ��Ŀ���ǣ� �� 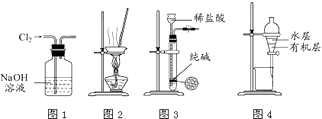
A.��ͼ1��ʾװ�ó�ȥCl2�к��е�����HCl
B.��ͼ2��ʾװ������NH4Cl������Һ�Ʊ�NH4Cl����
C.��ͼ3��ʾװ����ȡ����������CO2����
D.��ͼ4��ʾװ�÷���CCl4��ȡ��ˮ���ѷֲ���л����ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Zn��2MnO2��2H2O��2MnO(OH)��Zn(OH)2������˵���������
A.��������ͻ�ԭ��������ʵ���֮��Ϊ2��1
B.MnO(OH)��Mn�Ļ��ϼ�Ϊ��3��
C.MnO2�ڷ�Ӧ�б���ԭ
D.Zn�Ǵ˷�Ӧ�л�ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��O2��O3����Ԫ�ص����ֵ��ʣ����������ʽ������и��⣺
��1����������O2��O3�������Ӹ�����Ϊ �� ԭ�Ӹ�����Ϊ ��
��2�����µ�ѹ�£��������O2��O3�������Ӹ�����Ϊ �� ԭ�Ӹ�����Ϊ �� ������Ϊ ��
��3����NAΪ����٤����������ֵ�����a g�����к��еķ�����Ϊb����c g�����ڱ�״���µ����Լ�����ú�NA��ʽ�ӱ�ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ������Mg��Al�ֱ�Ͷ�������������У������������ڱ�״���µ������Ϊ�� ��
A.3��4
B.4��3
C.3��2
D.2��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������е����ʣ�ѡ���ʵ�����ĸ��Ҫ����գ� A����ˮ��B����ˮ��C��ǿ������
��1���ò�����պŨ�������ֽ�ϣ����ֱ�ڣ�˵��Ũ���������
��2��Ũ���᳣�����������˵��Ũ���������
��3��Ũ���ᶼ������ͭ��Ӧ����Ӧ��Ũ�����Ũ������ʾ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ�ӷϾ���ͨп�̵���������л����Ʊ�KMnO4�����ʵ�һ�ֹ��գ������ǷϾɵ����ʵ�ʴ��ڵ�����������������
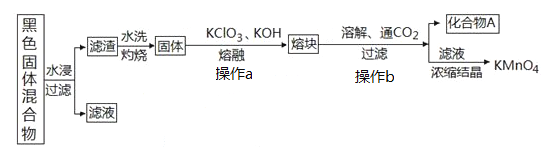
��1��KMnO4ϡ��Һ��һ�ֳ����������������������������������Ƶ���______________������ţ�
A��˫��ˮ B��75%�ƾ� C������ D��84����Һ��NaClO��Һ��
��2������ɫ��������ˮ��ʱΪ��߽������ʣ������õĴ�ʩΪ_________________������������ɣ���
������ˮϴ���պ������һ�ֺ�ɫ�Ļ��������a�еõ��ۿ����Ҫ�ɷ���K2MnO4��KCl���ù����з�����Ӧ�Ļ�ѧ����ʽΪ��_____________________________��
��ͼ�в���A��һ��������ˮ�ĺ�ɫ���壬�仯ѧʽΪ��_________________��
��3���ⶨKMnO4��Ʒ�Ĵ��ȿ��ñ�Na2S2O3��Һ���еζ���
������250mL0.1000mol��L-1��Na2S2O3��Һ����Ҫʹ�õIJ����������ձ�����ͷ�ιܡ���Ͳ��______��_______��
��ȡ�����Ƶõ�KMnO4��Ʒ0.7000g���ữ����0.1000mol��L-1��Na2S2O3��Һ���еζ����ζ����յ��¼ʵ������Na2S2O3��Һ��������ظ�������������ƽ��ʵ���������±���
ʵ����� | 1 | 2 | 3 |
����Na2S2O3��Һ���/mL | 19.30 | 20.98 | 21.02 |
(�й����ӷ���ʽΪ��MnO4-��S2O32-��H+��SO42-��Mn2+��H2O��δ��ƽ)
��0.1000mol��L-1��Na2S2O3��Һʢװ��________��������ʽ��������ʽ�����ζ����н��еζ��������KMnO4��Ʒ�Ĵ���_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������[aFe2��SO4��3b��NH4��2SO4cH2O]�㷺���ڳ�����������ˮ����ҵѭ��ˮ�ľ��������ȣ�ij����������������������������ƣ��������Ϊԭ�ϣ��������ͼ����������ȡ������泥� 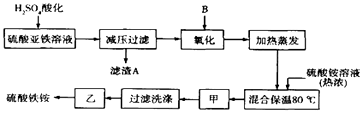
��ش��������⣺
��1������������Һ��H2SO4�ữ����ҪĿ����
��2���������������ʺϵ�������B�� ��
a��NaClO b��H2O2 c��KMnO4 d��K2Cr2O7
��3�������������ǣ��� ��
��4�����������У�����֮��ͼ�������֮ǰ����ȡ���������Լ��Ļ�ѧʽ������Fe2+�Ƿ���ȫ����������
��5����ȡ14.00g������Ʒ����������ˮ���Ƴ�100mL��Һ���ֳ����ȷݣ�������һ���м�������NaOH��Һ������ϴ�ӵõ�2.14g����������һ����Һ�м���0.05mol Ba ��NO3��2��Һ��ǡ����ȫ��Ӧ�����������淋Ļ�ѧʽΪ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com