

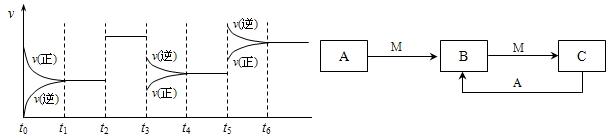
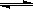 2SO3△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是______.
2SO3△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是______. 2SO3达到平衡后,SO3的体积分数为 a%,SO2的转化率为m.
2SO3达到平衡后,SO3的体积分数为 a%,SO2的转化率为m. 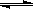 H2CO3+OH-;故答案为:HCO3-+H2O
H2CO3+OH-;故答案为:HCO3-+H2O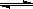 H2CO3+OH-;
H2CO3+OH-;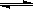 2SO3 △H<0,结合图象和影响化学平衡的因素分析;
2SO3 △H<0,结合图象和影响化学平衡的因素分析;

科目:高中化学 来源: 题型:
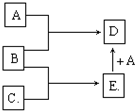 已知A、B、C均为常见的单质,其中A为金属,B、C为非金属,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略)
已知A、B、C均为常见的单质,其中A为金属,B、C为非金属,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略)

| ||
| ||
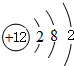
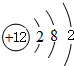
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 H2CO3+OH-
H2CO3+OH- H2CO3+OH-
H2CO3+OH- 2SO3△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是
2SO3△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是 2SO3达到平衡后,SO3的体积分数为 a%,SO2的转化率为m.
2SO3达到平衡后,SO3的体积分数为 a%,SO2的转化率为m. 查看答案和解析>>
科目:高中化学 来源:2010年山西省山大附中高三上学期期中考试化学卷 题型:填空题
已知:A、B、C均为常见的单质或化合物,它们在一定条件下有如下关系
A+H2O→B+C
(1)若A可作为呼吸面具和潜水艇中氧气的来源,则A与水反应的方程式为
;
(2)若A、B、C均为化合物,且B是酸,则该反应的化学方程式为 ;
(3)若B、C均为酸,则该反应的化学方程式为 ;
(4)若C为H2。B为氧化物,则A可能是(填化学式) 、 、
。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河南省灵宝市第三高级中学高一上第三次质量检测化学(带解析) 题型:推断题
已知A、B、C均为常见的单质,其中A为金属,B、C为非金属,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略).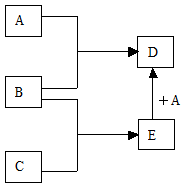
请回答:
(1)若常温下B、C均为气体,D为黑色晶体,E的化学式为______,A和E在一定条件下反应生成D的化学方程式为_____________.
(2)若常温下B为气体,C为黑色固体,则构成金属A的原子结构示意图为_______,E的化学式为___________,A和E在一定条件下反应生成D的化学方程式为___________.
查看答案和解析>>
科目:高中化学 来源:2010年山西省高三上学期期中考试化学卷 题型:填空题
已知:A、B、C均为常见的单质或化合物,它们在一定条件下有如下关系
A+H2O→B+C
(1)若A可作为呼吸面具和潜水艇中氧气的来源,则A与水反应的方程式为
;
(2)若A、B、C均为化合物,且B是酸,则该反应的化学方程式为 ;
(3)若B、C均为酸,则该反应的化学方程式为 ;
(4)若C为H2。B为氧化物,则A可能是(填化学式) 、 、
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com