
【题目】实验室用铁片和稀硫酸制备H2。下列说法不正确的是
A. 升高温度能加快反应速率 B. 用铁粉代替铁片能加快反应速率
C. 滴入数滴CuSO4溶液能加快反应速率 D. 增加H2SO4用量能加快反应速率
科目:高中化学 来源: 题型:
【题目】有关高温结构陶瓷和光导纤维的说法正确的是( )
A.高温结构陶瓷具有耐高温、不怕氧化、耐酸碱腐蚀、硬度小、耐磨损、密度大的特点
B.氮化硅陶瓷抗腐蚀能力强,它不与任何无机酸反应
C.氧化铝陶瓷的熔点低,硬度小
D.光导纤维传导光的能力非常强,利用光缆通信,能同时传输大量信息
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性:![]() >H2CO3>
>H2CO3>![]() , 将
, 将 转变为
转变为![]() 的方法是( )
的方法是( )
A.与足量的NaOH溶液共热,再通入足量的CO2
B.与稀H2SO4共热后,加入足量的NaOH溶液
C.加热溶液,通入足量的CO2
D.与稀H2SO4共热后,加入足量的Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学--选修5:有机化学基础]秸秆(含多糖物质)的综合应用具有重要的意义.下面是以秸秆为原料合成聚酯类高分子化合物的路线:
回答下列问题:
(1)下列关于糖类的说法正确的是 . (填标号)
a.糖类都有甜味,具有CnH2mOm的通式
b.麦芽糖水解生成互为同分异构体的葡萄糖和果糖
c.用银镜反应不能判断淀粉水解是否完全
d.淀粉和纤维素都属于多糖类天然高分子化合物
(2)B生成C的反应类型为 .
(3)D中官能团名称为 , D生成E的反应类型为 .
(4)F的化学名称是 , 由F生成G的化学方程式为 .
(5)具有一种官能团的二取代芳香化合物W是E的同分异构体,0.5mol W与足量碳酸氢钠溶液反应生成44gCO2 , W共有种(不含立体结构),其中核磁共振氢谱为三组峰的结构简式为 .
(6)参照上述合成路线,以(反,反)﹣2,4﹣己二烯和C2H4为原料(无机试剂任选),设计制备对二苯二甲酸的合成路线 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物C是一种医药中间体,可通过下列方法合成:
(1)A中含氧官能团的名称为和 .
(2)B的结构简式为 .
(3)B→C的反应类型为 .
(4)C的同分异构体D能发生银镜反应,能与FeCl3溶液发生显色反应,且1molD最多能与2molNaOH反应.D分子中有4种不同化学环境的氢.请写出D的一种结构简式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4 . 考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图),使浆液分离成固体混合物和含铬元素溶液,并回收利用.回答Ⅰ和Ⅱ中的问题.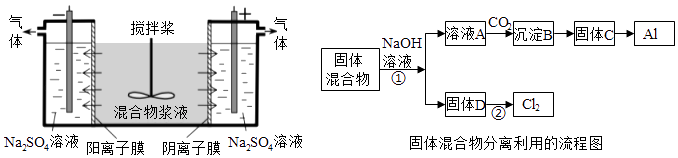
Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为 . B→C的反应条件为 , C→Al的制备方法称为 .
(2)该小组探究反应②发生的条件.D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2 . 由此判断影响该反应有效进行的因素有(填序号) .
a.温度 b.Cl﹣的浓度 c.溶液的酸度
(3)0.1mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2xH2O的液态化合物,放热4.28kJ,该反应的热化学方程式为 .
Ⅱ含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42﹣能从浆液中分离出来的原因是 , 分离后含铬元素的粒子是;阴极室生成的物质为(写化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景.回答下列问题:
(1)Co基态原子核外电子排布式为 . 元素Mn与O中,第一电离能较大的是 , 基态原子核外未成对电子数较多的是 .
(2)CO2和CH3OH分子中C原子的杂化形式分别为和 .
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为 , 原因是 .
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在 .
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2﹣)为nm.MnO也属于NaCl型结构,晶胞参数为a'=0.448nm,则r(Mn2+)为nm.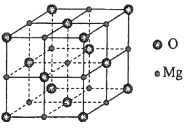
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com