
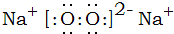 ��
��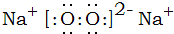 ������ɫ�����ܽ⣬����ɫ��ζ���������ɣ�NaOH��H2O2��
������ɫ�����ܽ⣬����ɫ��ζ���������ɣ�NaOH��H2O2��
| ||
| ||


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����볣������ҺŨ�ȵ�Ӱ�� | ||
| B�����볣�����Ա�ʾ������ʵ����ǿ�� | ||
| C�����볣���������c��H+��һ���ȵ��볣��С�����е�c��H+���� | ||
D��H2CO3�ĵ��볣������ʽ��K=
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��150mL1mol?L-1�Ȼ�����Һ |
| B��75mL1mol?L-1�Ȼ�����Һ |
| C��150mL2mol?L-1�Ȼ�����Һ |
| D��75mL2mol?L-1�Ȼ�����Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��2NH4Cl+Ca��0H��2�T2NH3+2H20+CuCl2 |
| B��2Na202+2H20�T4Na0H+02 |
| C��2S02+02�T2S03 |
| D��Cu+2H2S04��Ũ���TCuS04+S02+2H20 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������ˮ��Ӧ��Na+2H2O=Na++2OH-+H2�� |
| B����������ˮ��Cl2+H2O?2H++Cl-+ClO- |
| C��������Һ�м������ۣ�2Fe+6H+=2Fe3++3H2O |
| D��̼��������Һ�м�������������Һ��HCO3-+OH-=CO32-+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���٢� | B���ڢ� | C���� | D���ۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ȫ�������ů�Ѿ���Ϊȫ�����������ٵ��ش����⣬�¼ұ������ڡ��籾�������顱�ϳ�ŵ��2020���й�������������40%��
ȫ�������ů�Ѿ���Ϊȫ�����������ٵ��ش����⣬�¼ұ������ڡ��籾�������顱�ϳ�ŵ��2020���й�������������40%��| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| T/�� | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
| n(NH3) |
| n(CO2) |
| OH- |
| H+ |
| c��HCO3-����c��H2CO3�� | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com