
【题目】氢键对物质性质具有一定的影响,下列现象与氢键无关的是
A.水在结冰时体积膨胀
B.NH3比PH3热稳定性好
C.邻羟基苯甲醛沸点比对羟基苯甲醛低
D.甘油、浓硫酸都呈黏稠状
科目:高中化学 来源: 题型:
【题目】某同学购买了一瓶“84消毒液”,包装说明如下,请根据以上信息和相关知识判断,下列分析不正确的是( )

A. 该“84消毒液”的物质的量浓度约为4.0 mol·L-1
B. 一瓶该“84消毒液”敞口放置一段时间后浓度会变小
C. 取100 mL该“84消毒液”稀释100倍用以消毒,稀释后溶液中c(Na+)约为0.04mol·L-1
D. 参阅该“84消毒液”的配方,欲用NaClO固体配制含25%NaClO的消毒液480 mL,需要称量的NaClO固体质量为143 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列叙述正确的是
A. 标准状况下,11.2 L水中含有的氢原子数为NA
B. 1 mol·L-1FeCl3溶液中,阳离子数为NA
C. 一定条件下,将1mol SO2和0.5 mol O2充入一密闭容器内,充分反应后的生成物分子数为NA
D. 在反应2Na2O2+2CO2![]() 2Na2CO3+O2中,每生成0.5 molO2转移的电子数为NA
2Na2CO3+O2中,每生成0.5 molO2转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Fe棒和Cu棒用导线连接,放入某电解质溶液中,构成如图所示装置。试回答下列问题:

(1)若电解质溶液为硫酸溶液,则Cu棒上发生的电极反应为_________________。
(2)若电解质溶液为硫酸铜溶液,则Cu棒上的现象为____________________。
(3)若电解质溶液为氯化钠溶液,且在Cu棒附近不断通入氧气,则Cu棒上的电极反应为________________。
(4)若电解质溶液为浓硝酸,则Fe棒上发生的电极反应为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+ B2(g) = 2AB(g)的能量变化如图所示,判断下列叙述中正确的是

A.每生成2分子AB吸收bkJ热量
B.断裂1molA—A和1molB—B键,放出akJ能量
C.该反应中反应物的总能量高于生成物的总能量
D.该反应热△H=+(a-b)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10﹣5 | K1=4.3×10﹣7 K2=5.6×10﹣11 | 3.0×10﹣8 |
回答下列问题:
(1)在一条件下,CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3CH3COO﹣+H+ △H>0 ,下列方法中,可以使0.10mol·L﹣1CH3COOH溶液中CH3COOH电离程度增大的是_________。
CH3CH3COO﹣+H+ △H>0 ,下列方法中,可以使0.10mol·L﹣1CH3COOH溶液中CH3COOH电离程度增大的是_________。
a.加入少量0.10mol·L﹣1的稀盐酸 b.加热
c.加水稀释至0.010mol·L﹣1 d.加入少量冰醋酸
(2)等物质的量浓度的Na2CO3、NaClO、CH3COONa、NaHCO3的pH由大到小的顺序是____________。
(3)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是___________。
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)c(OH﹣) D.c(OH﹣)/c(H+)
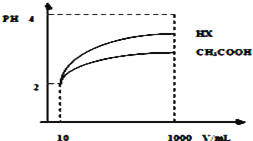
(4)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图所示.则HX的电离平衡常数____________(填“大于”、“等于”或“小于”)醋酸的平衡常数;稀释后,HX溶液中水电离出来的c(H+)______________醋酸溶液水电离出来c(H+)(填“大于”、“等于”或“小于”)。
(5)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO﹣)﹣c(Na+)=_________________(填准确数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废水脱氮工艺中有一种方法是在废水中加入过量NaClO使NH4+完全转化为N2,该反应可表示为2NH![]() +3ClO-===N2↑+3Cl-+2H++3H2O。下列说法中不正确
+3ClO-===N2↑+3Cl-+2H++3H2O。下列说法中不正确
A. 反应中氮元素被氧化,氯元素被还原
B. 还原性:NH4+>Cl-
C. 反应中每生成1 mol N2,转移6 mol电子
D. 经此法处理过的废水可以直接排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列微粒半径大小比较正确的是
A. Na<Mg<Al<S B. I<Br<Cl<F
C. Na+<Mg2+<Al3+<O2- D. S2->Cl->Na+>Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
①干冰与CO2; ②白磷与红磷; ③![]() Cl与
Cl与![]() Cl;
Cl;
④液氯与氯水; ⑤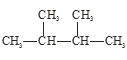 与
与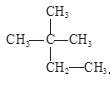 。
。
在上述各组物质中:
(1)互为同位素的是_____________;
(2)互为同素异形体的是__________,
(3)互为同分异构体的是_________;
(4)属于同种物质的是_________。(填序号)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com