
【题目】下列说法正确的是( )
A.含碳元素的化合物都是有机物
B.有机物都难溶于水
C.有机化合物与无机化合物的性质完全不同
D.大多数有机物受热易分解,但有的具有较强热稳定性
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在3个体积均为1.0 L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g) 达到平衡。下列说法正确的是
CH3OH(g) 达到平衡。下列说法正确的是

A. 该反应的正反应放热
B. 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C. 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D. 达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的由Cu和Cu2O组成的混合粉末加入到125 mL 2.6 mol·L-1的硝酸中,固体恰好完全溶解,得蓝色溶液X并收集到V mL(标准状况)的纯净无色气体Y。下列结论正确的是( )
A. X中有两种溶质
B. Y通入纯水中得到酸性溶液
C. 原混合粉末的总质量小于7.8 g
D. 当V=1 680时,原混合粉末中Cu和Cu2O的物质的量之比为8∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温下,反应C(s)+CO2(g) ![]() 2CO(g)不能自发进行,则该反应的ΔH>0
2CO(g)不能自发进行,则该反应的ΔH>0
B. 向醋酸中加水稀释,溶液中所有离子浓度均减小
C. 溶度积常数Ksp与温度有关,温度越高,溶度积越大
D. 吸热反应在常温下不能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图1表示同温度下,pH = 1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线II为盐酸,且b点溶液的导电性比a点强
B. 图2表示0.1000 mol/L CH3COOH溶液滴定20.00mL0.1000mol/LNaOH溶液所得到的滴定曲线
C. 图3表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
D. 据图4,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将锌铜合金溶解后与足量KI溶液反应(Zn2+不与I-反应),生成的I2用Na2S2O3标准溶液滴定,根据消耗的Na2S2O3溶液体积可测算合金中铜的含量。实验过程如下图所示:
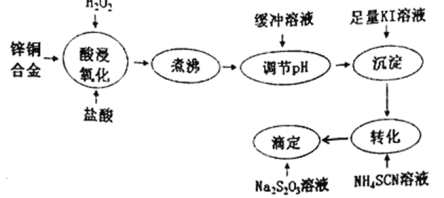
回答下列问题:
(1)H2O2的电子式为___________;“酸浸氧化”后铜元素的主要存在形式是___________(填离子符号)。
(2)“煮沸”的目的是____________________________________________。
(3)用缓冲溶液“调pH”是为了避免溶液的酸性太强,否则“滴定”时发生反应的离子方程式:_______________________________________________________;
①若100mLNa2S2O3溶液发生上述反应时,20s后生成的SO2比S多6.4g,则v(Na2S2O3)=___________mol/(L·s)(忽略溶液体积变化的影响)。
②该缓冲溶液是浓度均为0.10mol/L的CH3COOH和 CH3 COONH4的混合溶液。25℃时,溶液中各种离子浓度由大到小的顺序为_________________________________。(已知:25℃时,Ka(CH3COOH)=Kb(NH3·H2O)=1.8×10-5)
(4)“沉淀”步骤中有CuI沉淀产生,反应的离子方程式为______________________。
(5)“转化”步骤中,CuI转化为 CuSCN, CuSCN吸附I2的倾向比CuI更小,使“滴定”误差减小。沉淀完全转化后,溶液中c(SCN-):c(I-)≥___________。(已知:Ksp(CuI)=1.0×10-12;Ksp( CuSCN)=4.4×10-15)
(6)下列情况可能造成测得的铜含量偏高的是___________(填标号)。
A.铜锌合金中含少量铁
B.“沉淀”时,I2与I-结合生成I3-:I2+ I-= I3-
C.“转化后的溶液在空气中放置太久,没有及时滴定
D.“滴定”过程中,往锥形瓶内加入少量蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有研究人员设计了如下利用含硫物质热化学循环实现太阳能的转化与存储的过程.

回答下列问题:
(1)反应I中,主要能量转化形式为__________能转化为_____________能。
(2)S在元素周期表中位于第___________周期第_____________族。
(3)下列事实中,能说明硫的非金属性比碳强的是__________________(填标号)。
A.H2SO3的酸性比H2CO3的酸性强
B.在硫与碳的化合物CS2中S显负价
C.硫的单质的硬度比金刚石低
(4)配平反应Ⅱ的化学方程式:________SO2+_________H2O=______H2SO4+______S,该反应中氧化剂是_______________。
(5)通过反应Ⅲ也可以不经过热能转化过程而直接获取电能,化学上将实现这一直接转化的装置称为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似。气态时,已知断裂1mol N—N键吸收193kJ热量,断裂1mol N≡N键吸收941kJ热量,则( )
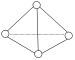
A. N4与N2互称为同位素 B. 1mol N4气体转化为N2时要吸收748kJ能量
C. N4是N2的同系物 D. 1mol N4气体转化为N2时要放出724kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:2SO2(g)+O2(g)![]() 2SO3(g),其正反应放热。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是( )
2SO3(g),其正反应放热。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是( )

A. 容器I、Ⅲ中平衡常数相同
B. 容器II、Ⅲ中正反应速率相同
C. 容器Ⅱ、Ⅲ中的反应达平衡时,SO3的体积分数:II 〈 III
D. 容器Ⅰ中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com