
��23��)��ҵ��һ���ں����ܱ���������H2��CO����ȼ�ϼ״�����Ӧ����ʽΪCO��g��+2H2��g��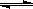 CH3OH��g����H
CH3OH��g����H
��1���±����������Ƿ�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
| �¶� | 250��C | 300��C | 350��C |
| K | 2��041 | 0��270 | 0��012 |
| ���� | �� | �� | �� | |
| ��Ӧ��Ͷ���� | 1molCO��2moL H2 | 1molCH3OH | 2molCH3OH | |
| ƽ�� ʱ�� ���� | CH3OHŨ�ȣ�mol/L�� | c1 | c2 | c3 |
| ��Ӧ�������仯 | akJ | bkJ | ckJ | |
| ��ϵѹǿ��Pa�� | p1 | p2 | p3 | |
| ��Ӧ��ת���� | ��1 | ��2 | ��3 | |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014�콭��ʡ��У�߶�����һ���¿���ѧ�Ծ��������棩 ���ͣ������
��23��)��ҵ��һ���ں����ܱ���������H2��CO����ȼ�ϼ״�����Ӧ����ʽΪCO��g��+2H2��g��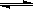 CH3OH��g����H
CH3OH��g����H
��1���±����������Ƿ�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
|
�¶� |
250��C |
300��C |
350��C |
|
K |
2��041 |
0��270 |
0��012 |
���ɱ��������жϡ�H 0���>������=����<����
��ij�¶��£���2molCO��6molH2����2L���ܱ������У���ַ�Ӧ�ﵽƽ��ʱ���c��CO��=0.2mol/L����CO��ת����Ϊ ����ʱ���¶�Ϊ ��
��2����100�� ѹǿΪ0.1 MPa������,�ݻ�ΪV Lij�ܱ�������a mol CO�� 2a mol H2�ڴ��������·�Ӧ���ɼ״�����ƽ��ʱCO��ת����Ϊ50%����100��÷�Ӧ�ĵ�ƽ�ⳣ��K= (�ú�a��V�Ĵ���ʽ��ʾ�������������ʽ)����ʱ�����¶��ݻ����䣬���������г���a mol CH3OH��g����ƽ�� ��������Ӧ�������淴Ӧ�����ƶ����ٴδﵽ��ƽ��ʱ��CO��������� ������С�������䣩
��3��Ҫ���CO��ת���ʣ����Բ�ȡ�Ĵ�ʩ�� ��
A������ B��������� C������CO��Ũ�� D�����ݳ���H2
E����ѹ����������� F��������״�
��4���жϷ�Ӧ�ﵽƽ��״̬�������ǣ�����ĸ��ţ���ͬ�� ��
A������CH3OH������������CO���������
B�����������ܶȲ���
C�������������ƽ��������������
D��CH3OH��CO��H2��Ũ�ȶ����ٷ����仯
��5��300��C�����ݻ���ͬ��3���ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ����й��������£�
|
���� |
�� |
�� |
�� |
|
|
��Ӧ��Ͷ���� |
1molCO��2moL H2 |
1molCH3OH |
2molCH3OH |
|
|
ƽ�� ʱ�� ���� |
CH3OHŨ�ȣ�mol/L�� |
c1 |
c2 |
c3 |
|
��Ӧ�������仯 |
akJ |
bkJ |
ckJ |
|
|
��ϵѹǿ��Pa�� |
p1 |
p2 |
p3 |
|
|
��Ӧ��ת���� |
��1 |
��2 |
��3 |
��ѡ����ȷ����������������ѡ��
��c1��c2��c3�Ĺ�ϵ������ȷ��Ϊ
A��c3>2c1 B��c1<c3<2c1 C��c1=c2
��a��b��c�Ĺ�ϵ������ȷ��Ϊ
A��c<2|��H| B��a+b=|��H| C��c=2b
��p1��p2��p3�Ĺ�ϵ����ȷ��Ϊ
A��p1=p2 B��p2<p3<2p2 C��p3>2p2
�ܦ�1����2����3�Ĺ�ϵ���ﲻ��ȷ��Ϊ
A����1=��2 B����3<��2 C����1+��2=1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com