
| A. | 平衡向正反应方向移动 | B. | 物质B的转化率降低 | ||
| C. | x+y<z | D. | 物质C的体积分数增大 |
分析 根据将容器的容积扩大到原来的两倍,若不考虑平衡移动,只考虑体积变化,A的浓度应变化为0.5mol/L,题干中再达到平衡时,测得A的浓度降低为0.60mol/L,说明体积增大,压强减小,平衡逆向进行,依据平衡移动方向分析判断选项中的问题.
解答 解:一定量的气体在密闭容器中发生反应:xA(g)+yB(g)?zC(g),平衡时测得A的浓度为1.0mol•L-1,将容器的容积扩大到原来的两倍,若不考虑平衡移动,只考虑体积变化,A的浓度应变化为0.5mol/L,题干中再达到平衡时,测得A的浓度降低为0.60mol/L.,说明体积增大,压强减小,平衡逆向进行;
A、平衡逆向进行,故A错误;
B、平衡逆向进行,B的转化率减小,故B正确;
C、体积增大,压强减小,化学平衡逆向进行,逆向是气体体积增大的反应,所以x+y>z,故以错误;
D、平衡逆向进行,C的体积分数减小,故D错误;
故选:B.
点评 本题考查化学平衡计算及化学平衡移动,明确体积变化引起A的浓度变化是解答本题的关键,注意动态变化与静态变化相结合得出平衡正向移动即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ①③⑤ | C. | ①④⑤ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
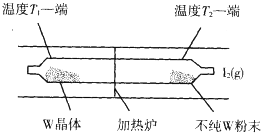 利用“化学蒸气转移法”提纯金属钨的反应原理为:W(s)+I2(g)?WI2(g)△H<0
利用“化学蒸气转移法”提纯金属钨的反应原理为:W(s)+I2(g)?WI2(g)△H<0查看答案和解析>>
科目:高中化学 来源: 题型:解答题

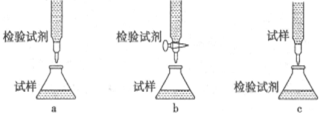
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2C=CH-CH2-CH3 | B. | 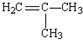 | C. | H2C=CH2 | D. | 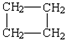 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫有漂白性,常用作棉、麻、纸张和食品的漂白 | |
| B. | 大量使用化肥和农药,以提高农作物产量 | |
| C. | 汽车排放的尾气中含有NO、CO2等大气污染物 | |
| D. | 安装煤炭“固硫”装置,可以降低酸雨发生率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com